
 三氯氢硅(SiHCl3)是生产多晶硅的主要原料.由粗硅制三氯氢硅的反应如下:
三氯氢硅(SiHCl3)是生产多晶硅的主要原料.由粗硅制三氯氢硅的反应如下:| 反应的热化学方程式 | 平衡常数(300℃) | |
| 主反应 | Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H=-210kJ•mol-1 | K1(mol•L-1)-1 |
| 副反应 | Si(s)+4HCl(g)?SiHCl4(g)+2H2(g)△H=-240kJ•mol-1 | K2(mol•L-1)-1 |
 .
.分析 (1)碳元素与硅元素在同一主族,根据三氯甲烷的结构式书写三氯硅烷结构式;
(2)SiHCl3,中H为+1价,Cl为-1价,故硅为+2价,根据氧化还原化合价升价守恒、质量守恒书写反应为:SiHCl3+5NaOH=3NaCl+Na2SiO3+H2↑+2H2O;
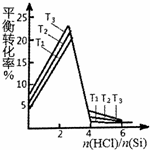
(3)主反应和副反应均为放热反应,升高温度,平衡逆向移动,硅的转化率降低,故T1>T2>T3;
(4)根据平衡常数表达式计算,根据影响平衡移动的因素分析解释;
(5)根据盖斯定律计算分析300℃时该反应的热化学方程式.
解答 解:(1)碳元素与硅元素在同一主族,根据三氯甲烷的结构式书写三氯硅烷结构式为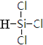 ,故答案为:
,故答案为: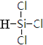 ;
;
(2)SiHCl3,中H为+1价,Cl为-1价,故硅为+2价,根据氧化还原化合价升价守恒、质量守恒书写反应为:SiHCl3+5NaOH=3NaCl+Na2SiO3+H2↑+2H2O,
故答案为:SiHCl3+5NaOH=3NaCl+Na2SiO3+H2↑+2H2O;
(3)主反应和副反应均为放热反应,升高温度,平衡逆向移动,硅的转化率降低,故答案为:T1>T2>T3;
(4)根据平衡常数表达式计算,$\frac{a}{b}$=主反应-副反应=K1/K2;根据影响平衡移动的因素分析,通入H2后两个平衡均逆向移动,由于副反应在氢气的比例较主反应大,对副反应影响比主反应更大,副反应中消耗SiHCl4多,所得产物中副产物的含量减小,所以SiHCl3的纯度提高,
故答案为:K1/K2;通入H2后两个平衡均逆向移动,但对副反应影响更大,所得产物中副产物的含量减小,所以SiHCl3的纯度提高;
(5)根据盖斯定律计算分析300℃时的反应,该式子为①Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H1=-210kJ•mol-1②Si(s)+4HCl(g)?SiHCl4(g)+2H2(g) ③△H2=-240kJ•mol-1;H2(g)+SiCl4(g)=SiHCl3(g)+HCl(g)△H ③为①-②,故△H=△H1-△H2=+30 kJ•mol-1,
故答案为:H2(g)+SiCl4(g)=SiHCl3(g)+HCl(g)△H=+30 kJ•mol-1.
点评 本题考查了物质的转化和制备题,还考查了化学方程式的书写.本题利用文字描述设计出相应的实验步骤,分步骤进行鉴别,解决本考点需要根据实验现象,综合分析,从而得出正确的结论,要注意知识的整体性,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:填空题
 请回答:
请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 加入物质 | 现象 | 解释或离子方程式 |
| A | AgNO3溶液 | 有白色沉淀生成 | Cl-+Ag+═AgCl↓ |
| B | 石蕊试液 | 显红色 | 氯水中有盐酸、次氯酸 |
| C | CaCO3 | 有气体放出 | CO32-+2H+═H2O+CO2↑ |
| D | FeCl2和KSCN溶液 | 有红色沉淀生成 | 2Fe2++Cl2═2Fe3++2Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 水的电离程度始终增大 | |
| B. | c(NH4+):c(NH3•H2O)始终减小 | |
| C. | c(CH3COOH)与c(CH3COO?)之和始终保持不变 | |
| D. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
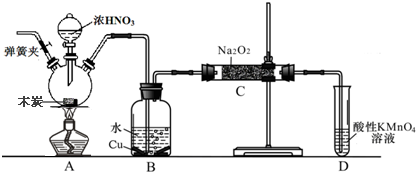
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在密闭定容体系中降温,混合气颜色变浅,体系压强增大 | |
| B. | 只降温,混合气体颜色变浅,说明正反应是放热的 | |
| C. | 加压时,混合气颜色开始变浅,后来又逐渐加深 | |
| D. | 加压时,混合气颜色开始变深,后来又逐渐变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验内容 | 实验现象 | 解释及结论 |
| 观察氯水的颜色、状态 | 呈黄绿色 | ① C |
| 向氯水中滴入几滴硝酸银溶液 | 有白色沉淀 | ② A |
| 用玻璃棒蘸取氯水,点在蓝色石蕊试纸上 | 滴有氯水的试纸中间变白,外圈变红 | ③ B |
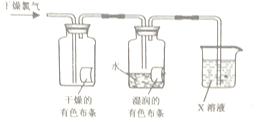
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com