
| A. | 工业上常使用过量的空气,目的是为了使SO2的转化率达100% | |
| B. | 工业上选用V2O5作该反应的催化剂,目的是为了加快化学反应速率 | |
| C. | 工业上常选用常压,原因是增大压强不能改变该反应的化学反应速率 | |
| D. | 升高温度可以加快反应速率,所以在工业生产中该反应温度越高越好 |
分析 A、该反应是可逆反应,反应物不能完全转化;
B、加入催化剂可以改变化学反应速率,根据工业生产选择合适的催化剂;
C、增大压强能加快化学反应速率;
D、升高温度使得化学反应速率加快,但温度过高反应转换率低并且会使催化剂失效;
解答 解:A、可逆反应的反应物不能完全转化,所以SO2的转化率达不到100%,故A错误;
B、加入催化剂可以加快化学反应速率,故B正确;
C、增大压强能加快化学反应速率,故C错误;
D、升高温度使得化学反应速率加快,但温度过高反应转换率低并且会使催化剂失效,故D错误.
故选B.
点评 本题考查影响化学反应速率的因素:温度、浓度、催化剂、压强等,注意催化剂的特点是解题的易错点,难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铁钝化 | |
| B. | 浓硫酸与蔗糖混合搅拌产生刺激性气味气体,此过程只体现了浓硫酸的脱水性 | |
| C. | 某溶液中加盐酸产生使澄清石灰水变浑浊的气体,说明该溶液中一定含CO32- 或SO32- | |
| D. | 某溶液中滴加BaCl2.溶液产生不溶于稀硝酸的白色沉淀,不能说明该溶液中一定含SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Cl2 $\stackrel{光照}{→}$CH3CH2Cl+HCl | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$H3COOCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式: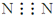 | |
| B. | 乙酸乙酯的结构简式:C4H8O2 | |
| C. | O2-的结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2═Ba2++(OH-)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com