
����Ŀ����Ԫ�����ڱ��У�һϡ������Ԫ��ԭ�ӵ��������ӹ���Ϊ4s24p6 �� ����ͬ���ڵ�A��B��C��D����Ԫ�أ����ǵ�ԭ����������������Ϊ2��2��1��7������A��C��Ԫ��ԭ�ӵĴ���������Ϊ8��B��D��Ԫ��ԭ�ӵĴ���������Ϊ18��E��D��Ԫ�ش���ͬ�壬���ڸ���Ԫ���У�E����̬�⻯��ķе���ߣ�
��1��BԪ�������ڱ��е�λ����DԪ�ػ�̬ԭ�ӵ����Ų�ʽΪ ��
��2��E����̬�⻯����ͬ��Ԫ���зе���ߵ�ԭ���ǣ� ��
��3��A��C��Ԫ�ص�һ�������� �� ����Ԫ�ط��ţ�
��4��BԪ�����γɶ�������Ԫ��֮���γ������������ǣ�һ�����ܹ��ṩ�¶Ե��ӵ�ԭ�ӣ���һ������ԭ�ӣ�
��5��AԪ�ؿ�����Ԫ���γ����ӻ��������ʽΪ���������ӻ��������ˮ��Ӧ����ѧ����ʽΪ
���𰸡�
��1���������ڢ�B�壻1s22s22p63s23p63d104s24p5
��2��HF���Ӽ�������
��3��Ca��K
��4���ṩ�չ��
��5��![]() ��CaH2+2H2O=Ca��OH��2+2H2��
��CaH2+2H2O=Ca��OH��2+2H2��
���������⣺��Ԫ�����ڱ��У�ijϡ������Ԫ��ԭ�ӵ��������ӹ���Ϊ4s24p6 �� ���ڵ������ڣ�����ͬ���ڵ� A��B��C��D����Ԫ�أ����ǵ�ԭ����������������Ϊ2��2��1��7������A��C��Ԫ��ԭ�ӵĴ���������Ϊ8����AΪCa��CΪK��B��D��Ԫ��ԭ�ӵĴ���������Ϊ18����BΪZn��DΪBr��E��D��Ԫ�ش���ͬ�壬���ڸ���Ԫ����E����̬�⻯��ķе���ߣ���EΪF����1��BΪZnԪ�أ���������Ų�ʽΪ��1s22s22p63s23p63d104s2 �� �������ڱ��е������ڢ�B�壬DΪBrԪ�أ�����35�����ӣ���̬ԭ�ӵ����Ų�ʽΪ��1s22s22p63s23p63d104s24p5�� ���Դ��ǣ��������ڢ�B�壻1s22s22p63s23p63d104s24p5����2��HF���Ӽ����������ƻ�����Ҫ�ϸߵ����������Էе�ϸߣ�
���Դ��ǣ�HF���Ӽ�����������3��CaԪ��ԭ��4s�ܼ�����2�����ӣ�Ϊȫ���ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������Ca��K��
���Դ��ǣ�Ca��K����4�����йµ��ӶԵ�ԭ���뺬�пչ����ԭ�����γ���λ����
���Դ��ǣ��ṩ�չ����
������Ca��K�ĵ��ʻ������ǵ��⻯��Ĺ��壬������ˮ���ҷ�Ӧ�������壬������ӦΪ��Ca+2H2O=Ca��OH��2+H2����2K+2H2O=KOH+H2����CaH2+2H2O=Ca��5���⻯��Ϊ���ӻ������ʧȥ2�����Ӹ�Hԭ�ӣ��Ӷ��γ���H�����ӣ������ʽΪ�� ![]() ���⻯����ˮ��Ӧ�����������ƺ��������䷴Ӧ����ʽΪ��CaH2+2H2O=Ca��OH��2+2H2����
���⻯����ˮ��Ӧ�����������ƺ��������䷴Ӧ����ʽΪ��CaH2+2H2O=Ca��OH��2+2H2����
���Դ��ǣ� ![]() ��CaH2+2H2O=Ca��OH��2+2H2����
��CaH2+2H2O=Ca��OH��2+2H2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)49 g H2SO4�����ʵ�����________��1.5 mol H2SO4��������_______�����к���_______ mol H������_______g O��
(2)Ħ��������ָ��λ���ʵ��������������е�������
����֪NH3����Է�������Ϊ17����NH3��Ħ������Ϊ________��
��NAΪ�����ӵ���������֪a gij�����к�������Ϊb����������Ħ������Ϊ________��
����֪һ����ԭ�ӵ�����Ϊb g������ԭ��Ħ������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������ڴ��������еĵ�����������Ļ�ѧ��ӦΪ��2NH3��g��+NO��g��+NO2��g�� ![]() 2N2��g��+3H2O��g����H��0�ں��ݵ��ܱ������У������й�˵����ȷ���ǣ� ��
2N2��g��+3H2O��g����H��0�ں��ݵ��ܱ������У������й�˵����ȷ���ǣ� ��
A.ƽ��ʱ�������������䣬�����¶ȿ�ʹ�÷�Ӧ��ƽ�ⳣ������
B.ƽ��ʱ�������������䣬����NH3��Ũ�ȣ������е��������ת���ʼ�С
C.��λʱ��������NO��N2�����ʵ�����Ϊ1��2ʱ����Ӧ�ﵽƽ��
D.�����������䣬ʹ�ø�Ч�����������е��������ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��������Ҫ��Ӧ��ú��̼��ˮ������Ӧ����CO��H2�ȣ��ش��������⣺
��1��CO��H2�ֱ���O2��������Ƴ�ȼ�ϵ�أ�CO��O2��Ƴ�ȼ�ϵ�أ�������̼����Ϊ����ʣ������ĵ缫��ӦΪ
��2����ú��������õĻ���ԭ�����к��������ʻ���COS������������ж���������Ⱦ�ȣ�COS�ĵ���ʽΪ�ʻ������ռ���Һ��Ӧ����ˮ���������ε����ӷ���ʽΪ�ʻ�������������ַ������䷴Ӧʽ�ֱ�Ϊ�� ����ⷴӦ��COS��g��+H2��g���TH2S��g��+CO��g����H1=+7kJ/mol
��ˮ�ⷴӦ��COS��g��+H2O��g���TH2S��g��+CO2��g����H2
��֪��Ӧ����صĻ�ѧ�������������
��ѧ�� | C=O��CO2�� | C=O��COS�� | C=S | H��S | H��O |
���ܣ�kJ/mol�� | 803 | 742 | 577 | 339 | 465 |
���H2=kJ/mol
��3�����������CO��H2�ڴ��������ºϳɼ״���CO2��g��+3H 2��g��CH3OH��g��+H2O��g����H2=��90.14kJ/mol���÷�Ӧ���Է��������� �� ��һ���¶��£��������ݻ���ΪVL�ĺ����ܱ������У������·�ʽ��Ӧ�һ��ʱ���ﵽƽ��
���� | �� | �� |
��Ӧ��Ͷ���� | 1molCO2��3molH2 | mmolCO2��3mmolH2�� |
������ƽ��������ѹǿΪ��ʼ��0.8����Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���n��ȡֵ��ΧΪ �� ��Ӧ��ƽ�ⳣ��K= ��
�ڼ��������ֺ��ݣ�������H2��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ���������㼴�ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A����ͼ��ʾ��ת����ϵ 
��֪���л���B�Ƿ������ĺ������������Է�������Ϊ108��B��������������Ϊ14.8%
��CH3CH2COOH+Cl2 ![]()
![]() +HCl
+HCl
��G���ӽṹ�к���3����Ԫ��
����������Ϣ���ش��������⣺
��1���л���F�й����ŵ������� ��
��2��A�������� ��
��3�������� Ϊ �� F��G�ķ�Ӧ����Ϊ �� G�Ľṹ��ʽΪ ��
��4��д��һ�ּ���M�й����ŵĻ�ѧ����ʽ
��5��R��N��ͬϵ���Է���������N��14��R�ж���ͬ���칹�壬��ͬʱ��������������ͬ���칹�����֣����к˴Ź�������Ϊ4��壬�ҷ����֮��Ϊ3��2��2��1���л���ṹ��ʽΪ �� a�����б��� b���ܷ���������Ӧ c����FeCl3��Һ������ɫ d�������Ѽ�
��6��д������ת���Ļ�ѧ����ʽ��F��E ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MgH2��Mg2Cu������������ϣ�MgO������¯���������������Լ���
��1��MgH2��һ�����ӻ���������ʽΪ ��
��2��Mg2Cu�ڼ�ѹ�����´���ʱ����MgH2��MgCu2 �� �÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3����֪MgH2���й��Ȼ�ѧ����ʽ���£� MgH2��s��Mg��s��+H2��g����H1=+74.4 KJmol��1��
H2��g��+ ![]() O2��g���TH2O��g����H2=��241.8 KJmol��1��
O2��g���TH2O��g����H2=��241.8 KJmol��1��
Mg��s��+ ![]() O2��g���TMgO��s����H3=��141.6 KJmol��1 ��
O2��g���TMgO��s����H3=��141.6 KJmol��1 ��
���⻯þȼ����������þ��ˮ�������Ȼ�ѧ����ʽΪ ��
��MgH2���������ʱ����λ��������ͷų�������������ʱ��ı仯��ͼ����ʾ�������¶�T1��T2��T3��С�����˳��Ϊ �� 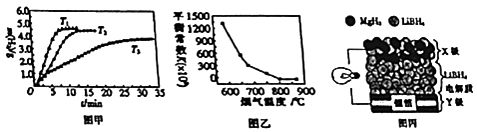
��4��¯�����ѳ�SO2��NO�ķ�ӦΪ2MgO��s��+2SO2 ��g��+2NO��g��2MgSO4��s��+N2��g����H=a KJmol��1 �� ��ƽ�ⳣ�����¶ȵĹ�ϵ��ͼ����ʾ�� ��������Ӧ��ƽ�ⳣ������ʽΪK= ��
��a�������������0��
��5��ȫ��̬����ӵ�صĽṹ��ͼ����ʾ���ŵ�ʱ��ط�ӦΪ2Li+MgH2�TMg+2LiH���ŵ�ʱ��X���ĵ缫��ӦʽΪ �� ���ʱ��Y���ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������CuS��Cu2S�Ļ����Ͷ��������HNO3�У��ռ�������V L����״��������Ӧ�����Һ�У�����Cu2+��SO42������������NaOH��������ɫ���������ˣ�ϴ�ӣ����գ��õ�CuO 12.0g������������ΪNO��NO2�Ļ����������Ϊ1��1����V����Ϊ�� ��
A.9.0 L
B.13.5 L
C.15.7 L
D.16.8 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������д���˳���칹����ǣ� ��
A. 2-�ȱ�ϩ B. ��ϩ C. 2-��ϩ D. 1-��ϩ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com