
| A、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
| B、稀HNO3溶液与难溶于水的FeS固体:FeS+2H+═Fe2++H2S↑ |
| C、碳酸氢镁与少量澄清石灰水反应:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
| D、强碱溶液中,次氯酸钠与Fe(OH)3:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HNO3的摩尔质量为63 |
| B、摩尔是物质的量的单位 |
| C、1mol任何物质都约含有6.02×1023个原子 |
| D、64g SO2中含有1mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2的相对分子质量为34g |
| B、1 mol SO42-的质量为96g |
| C、C2H4 的摩尔质量与6.02×1023CO分子的质量之和相等 |
| D、CH4的摩尔质量为16 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、②④⑤ |
| C、①②④ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
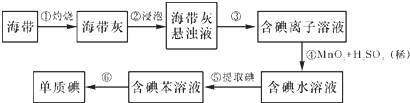
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com