
| 金属(粉末状)mol | 酸的浓度及体积 | 反应温度 | |
| A | Zn 0.1 | 6mol/L硝酸 10mL | 70℃ |
| B | Zn 0.1 | 3mol/L硫酸 10mL | 70℃ |
| C | Fe 0.1 | 3mol/L盐酸 10mL | 60℃ |
| D | Zn 0.1 | 3mol/L盐酸 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 相同条件下,pH=5的①NH4C1溶液、②CH3C00H溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③ | |
| C. | 体积相同、浓度均为0.1mol/L的盐酸和醋酸,分别稀释m倍、n倍,溶液的pH都变成5,则m<n | |
| D. | pH=5的硫酸溶液稀释到原来的500倍,稀释后溶液中的c(SO42-)与c(H+)之比约为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:F->Na+>Mg2+>Al3+ | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性:H2SiO3>H2CO3>H3PO4 | D. | 熔点:NaCl>SiO2>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| B. | 玛瑙和红宝石的主要成分都是SiO2,是制备半导体的材料 | |
| C. | 高温下SiO2能与Na2CO3反应放出CO2,说明硅酸酸性强于碳酸 | |
| D. | Na2SiO3溶液中逐滴加入盐酸可制备硅酸胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的还原性依次减弱 | B. | I、Br、Cl的非金属性性依次增强 | ||
| C. | C、N、O 的原子半径依次增大 | D. | P、S、Cl的最高正化合价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
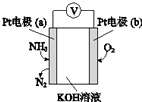 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com