
| A. | 1L1mol•L-1的Na2CO3溶液中含有CO32-的数目为NA | |
| B. | 28g的乙烯和丙烯中含碳原子数目为NA | |
| C. | 标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA | |
| D. | 常温常压下,14g由N2与CO组成混合气体含有的原子数目为NA |
分析 A.碳酸根离子为弱酸根离子,水溶液中部分发生水解;
B.乙烯和丙烯的最简式均为CH2;
C.二氧化氮与水反应生成硝酸和一氧化氮;
D.氮气和一氧化碳的摩尔质量都是28g/mol,14g二者的混合物的物质的量为0.5mol,含有1mol原子.
解答 解:A.因为碳酸根离子为弱酸根离子,水溶液中部分发生水解,所以1L1mol•L-1的Na2CO3溶液中含有CO32-的数目小于NA,故A错误;
B.乙烯和丙烯的最简式均为CH2,故28g混合物中含有的CH2的物质的量n=$\frac{28g}{14g/mol}$=2mol,故含有2NA个碳原子,故B错误;
C.标况下,6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成了0.1mol一氧化氮,转移了0.2mol电子,转移的电子数目为0.2NA,故C错误;
D.14gN2与CO组成的混合气体的物质的量为0.5mol,0.5mol混合气体中含有1mol原子,含有的原子数目为NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量与NA个硫酸分子的质量在数值上相等 | |
| B. | 6.02×1023个氮分子和6.02×l023个氢分子的质量比等于14:1 | |
| C. | 32g氧气所含的原子数目约为2×6.02×1023 | |
| D. | 标准状况下,0.5NA分氟化氢分子所占体积是11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4、KNO3、Na2CO3、NH4Cl | B. | H2SO4、BaCl2、Na2SO4、NaOH | ||
| C. | MgCl2、AgNO3、KNO3、HCl | D. | NH4HCO3、NaOH、NaCl、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度和压强下,各种气态物质体积的大小由构成气体的分子大小决定 | |
| B. | 一定温度和压强下,各种气态物质体积的大小由构成气体的分子数决定 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 常温常压下,相同粒子数的CuO、H2O、O2的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一组探究氯气性质的装置.
如图是一组探究氯气性质的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
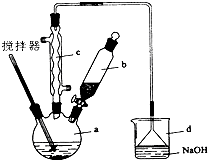 实验室制备苯乙酮的化学方程式为:
实验室制备苯乙酮的化学方程式为: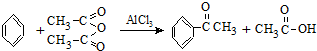
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com