
 有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如表:
有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如表:| 元素 | 元素的相关信息 |
| A | 存在多种核素,其中一种核素没有中子 |
| B | 核外电子排布式三个能级上的电子数相同 |
| C | 其第一电离能比同周期相邻元素的第一电离能都大 |
| D | 最外层电子数是内层电子数三倍的元素 |
| E | 单质或其化合物在火焰灼烧时,火焰呈黄色 |
| F | 位于第三周期ⅦA族 |
| G | 未成对电子数最多的副族元素 |
 ,
, ;
; ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
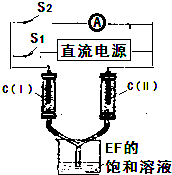
 )的化学性质与苯相似.
)的化学性质与苯相似. )外,最有可能生成的副产物(与H互为同分异构体)的结构简式是
)外,最有可能生成的副产物(与H互为同分异构体)的结构简式是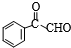 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| O2 |
| 催化剂 |
| Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
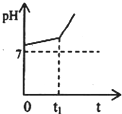 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:| [NH3?H2O] |
| [NH4+][OH-] |
| 5.56 |
| c(Ca2+) |
| c(Mn2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D | E |
| 性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
| 酸 | 电离常数 |
| HClO | Ka=3.0×10-8 |
| H2CO3 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C是单质,其中A是金属,各种物质间的转化关系如图:根据图示转化关系回答:
A、B、C是单质,其中A是金属,各种物质间的转化关系如图:根据图示转化关系回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 纳米级Cu2O由于具有优良的催化性能而受到科学研究的不断关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到科学研究的不断关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO | ||||
| 方法Ⅱ | 电解法,反应为2Cu+H2O
| ||||
| 方法Ⅲ | 用肼(N2H4)还原新制的Cu (OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验乙醛中的醛基:在一定量CuSO4溶液中,加入少量NaOH溶液,然后再加入乙醛,加热产生砖红色沉淀 |
| B、分离提纯苯:向苯和苯酚混合溶液中加入足量浓溴水,静置后分液 |
| C、比较CH3COO-和CO32-结合H+的能力:相同温度下,测定浓度均为0.1mol?L-1的Na2CO3和CH3COONa溶液的pH |
| D、检验蔗糖水解产物,向蔗糖溶液中加入稀硫酸溶液共热,冷却后滴入银氨溶液,观察有无银镜生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、sp2、sp2 |
| B、sp3、sp3 |
| C、sp2、sp3 |
| D、sp、sp2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com