
具有下列电子排布的原子,哪一个容易形成配位化合物( )
A.2s22p6 B.3s2
C.4s1 D.3d64s2
科目:高中化学 来源: 题型:
下列各组物质的无色溶液,不用其他试剂即可鉴别的是________。
①NaOH、AlCl3 ②NaHCO3、H2SO4 ③NaAlO2、NaHSO4 ④Na2CO3、HCl ⑤Na2CO3、NaHCO3、Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列反应的离子方程式:
(1)在氯化锌溶液中加入过量的氨水________________________________。
(2)在硫酸铜溶液中加入过量的浓氨水______________________________。
(3)氯化银溶于浓氨水____________________________________________。
(4)在FeCl3溶液中加入过量的氨水________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.BF3是三角锥形分子
B.NH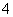 的电子式:
的电子式: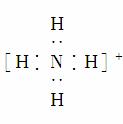 ,该离子呈平面正方形结构
,该离子呈平面正方形结构
C.CH4分子中的4个C—H键都是由氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D.CH4分子中,碳原子中的sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化过程中,原物质分子共价键被破坏,同时还有离子键形成的是( )
A.盐酸和NaOH溶液 B.氯化氢溶于水
C.溴化氢与氨反应 D.锌和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,平衡右移。你认为哪种说法正确?并说明原因。水的电离平衡移动后,溶液中c(H+)·c(OH-)是增大还是减小?
查看答案和解析>>
科目:高中化学 来源: 题型:
用标准盐酸溶液滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”、“偏低”或“无影响”填空。
(1)酸式滴定管未用标准溶液润洗( )
(2)锥形瓶用待测溶液润洗( )
(3)锥形瓶洗净后还留有蒸馏水( )
(4)放出碱液的滴定管开始有气泡,放出液体后气泡消失( )
(5)酸式滴定管滴定前有气泡,滴定终点时气泡消失( )
(6)部分酸液滴出锥形瓶外( )
(7)酸式滴定管滴定前读数正确,滴定后俯视读数(或前仰后俯)( )
(8)酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰)( )
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 | 35 mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
由此得出的结论正确的是 ( )。
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低
于16.2 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com