
分析 ①取少量待测液,仔细观察,呈无色,所以一定不含有Fe3+、MnO4-;
②向上述待测液中滴加NaOH溶液,开始阶段无明显现象,后有白色沉淀生成,则一定含有Mg2+,H+,一定不存在OH-;
③上述溶液中加入BaCl2溶液,无现象,一定不存在SO42-.
溶液显示中性,应该是阴阳离子均存在的,以此解答该题.
解答 解:①取少量待测液,仔细观察,呈无色,所以一定不含有Fe3+、MnO4-;
②向上述待测液中滴加NaOH溶液,开始阶段无明显现象,后有白色沉淀生成,则一定含有Mg2+,H+,一定不存在OH-;
③上述溶液中加入BaCl2溶液,无现象,一定不存在SO42-,
溶液显示中性,应该是阴阳离子均存在的,一定存在NO3-,
(1)综上:待测液中一定大量存在的离子是NO3-,Mg2+,H+,一定不能大量存在的离子是 Cu2+,Fe3+,SO42-,OH-,不能确定是否存在的离子是K+.
故答案为:NO3-,Mg2+,H+;Fe3+、OH-、SO42-、MnO4-;K+;
(2)②中加入氢氧化钠溶液后的离子反应方程式依次为H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓,故答案为:H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓.
点评 本题考查无机物的推断,为高频考点,侧重于常见的离子检验方法,题目难度中等,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 加入过量Na2CO3溶液:Na+、Ca2+、NH4+、NO3-、H+ | |
| B. | 加入适量NaHCO3溶液:Na+、Ca2+、NH4+、NO3-、HCO3- | |
| C. | 加入适量NaOH溶液:Na+、Ca2+、NH4+、NO3-、OH- | |
| D. | 加入过量FeSO4和稀硫酸:Fe2+、Fe3+、NH4+、Ca2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极发生氧化反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解后,溶液中存在的金属阳离子只有Ni2+和Zn2+ | |
| C. | 电解后溶液中Ni2+数目减少 | |
| D. | 电解后,电解槽底部的阳极泥中有Pt和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
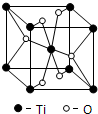
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.82g青蒿素含氧原子数目为0.05NA | |
| B. | 标准状况下,1 mol青蒿素的体积为22.4 L | |
| C. | 青蒿素含氧量为10% | |
| D. | 青蒿素的摩尔质量为282 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与碱反应生成盐和水 | B. | 使紫色石蕊试液变蓝色 | ||
| C. | 与活泼金属反应生成盐和氢气 | D. | 与氧化钠反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
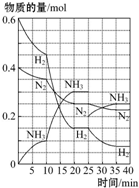 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 反应开始到第一次平衡时,N2的平均反应速率为0.062 5 mol•L-1•min-1,H2的转化率为75% | |
| B. | 反应35 min时,达到第二次平衡时,反应的平衡常数:K=$\frac{0.1{5}^{2}}{0.07{5}^{3}•0.125}$ | |
| C. | 从曲线变化可以看出,反应进行到10~20 min时可能采取的措施是使用了催化剂 | |
| D. | 从曲线变化可以看出,反应进行至25 min时,采取的措施是分离出0.1 mol的氨气,平衡向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
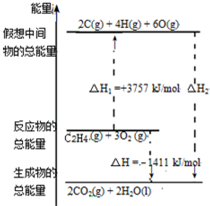 乙烯(C2H4结构式:
乙烯(C2H4结构式: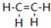 )既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
)既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)| A. | 542 | B. | 391 | C. | 1834 | D. | 917 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com