
| A、SO2、Na2O2、活性炭都能使品红溶液褪色,但原理不同 |
| B、水在3.98℃时,主要以(H2O)2存在,这两个水分子间是以共价键相结合 |
| C、放热反应 的反应速率,不一定比吸热反应的反应速快 |
| D、同温同压下,3mol C2H4(g)和1mol CO(g)的密度相等 |
| m |
| M |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、向稀硝酸中加入铁粉 |
| B、向氯化铝溶液中加入过量的氨水 |
| C、向NaOH溶液中通入CO2气体 |
| D、向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
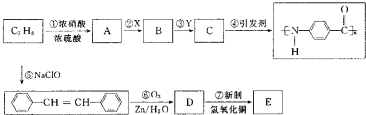
| O2,Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCI | NH4HCO3 | NaHCO3 | NH4CI | Na2SO4 | (NH4)SO4 | CaCI2 | MgCI2 | CaSO4 |
| 36.3 | 27.0 | 11.1 | 41.4 | 40.8 | 78 | 51.7 | 26.2 | 0.165 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
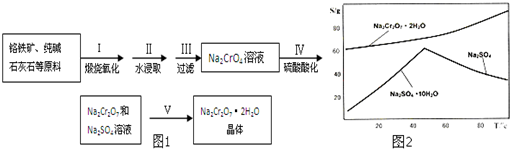
查看答案和解析>>
科目:高中化学 来源: 题型:
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| M(混合物) | 9.2g | 15.7g | 27.6g |
| V(标准状况) | 2.24L | 3.36L | 3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②⑤ |
| C、①④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
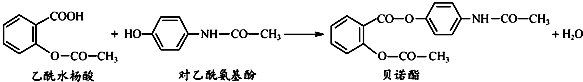
| A、乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应 |
| B、可用FeCl3 溶液区别乙酰水杨酸和贝诺酯 |
| C、贝诺酯分子中有2种含氧官能团 |
| D、贝诺酯与足量NaOH 溶液共热,生成乙酰水杨酸钠和对乙酰氨基酚钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com