
| A、氢化物沸点:HI>HBr>HCl>HF |
| B、分子稳定性:HF>HCl>HBr>HI |
| C、离子半径:K+>Cl->S2- |
| D、单质熔点:Li<Na<K<Rb |


科目:高中化学 来源: 题型:
 ),其余为氯原子.则氯原子的个数为( )
),其余为氯原子.则氯原子的个数为( )| A、2n+3m-a |
| B、n+m+a |
| C、m+2-a |
| D、m+2n+2-a |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)═2HCl(g) |
| B、氢气与氯气反应生成2 mol氯化氢气体,反应吸收183 kJ的热量 |
| C、氢气与氯气反应生成1 mol氯化氢气体,反应放出183 kJ的热量 |
| D、氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①③④ |
| C、②③⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
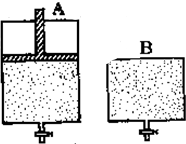 有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).
有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1>△H2>△H3 |
| B、△H1<△H3<△H2 |
| C、△H1=△H3>△H2 |
| D、△H1>△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2FeCl2→2FeCl3 |
| B、Br2+2Fe2+→2Fe3++2Br- |
| C、2FeCl3+2KI→2FeCl2+2KCl+I2 |
| D、I2+2Fe2+→2I-+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
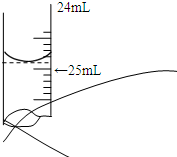 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol?L-1 HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 25.02 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 25.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com