
| A. | 16 | B. | 26 | C. | 36 | D. | 46 |
科目:高中化学 来源: 题型:选择题
 反应A2+B2?2AB,△H=QkJ/molB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
反应A2+B2?2AB,△H=QkJ/molB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )| A. | A2、B2及AB均为气体,Q>0 | |
| B. | AB为气体,A2、B2中有一种为非气体,Q>0 | |
| C. | AB为气体,A2、B2中有一种为非气体,Q<0 | |
| D. | AB为固体,A2、B2中有一种为非气体,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使紫色石蕊试液变红的溶液中:Fe2+、Na+、SO42-、NO3- | |
| B. | 碱性溶液中:Na+、K+、NO3-、ClO- | |
| C. | pH=1的溶液中:Na+、Cu2+、Cl-、S2- | |
| D. | 加入Al能放出氢气的溶液中:NH4+、SO42-、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物中都存在同分异构现象 | |
| B. | 只要含有的官能团种类相同就是同系物 | |
| C. | 14C和14Si是同位素 | |
| D. | C2H5Cl没有同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | 平衡向正反应方向移动 | ||
| C. | m+n>p | D. | C的质量分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
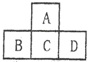 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答: ,.
,.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 形成产物C和D的化学键放出的总能量高于断开反应物A和B的化学键所吸收的总能量 | |
| B. | 该反应只有在加热条件下才能进行 | |
| C. | 反应物的总能量高于产物的总能量 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com