
���Ṥҵ�У���Ϊ������V2O5�Է�ӦI�Ĵ�ѭ�����̾����ˢ�������Ӧ�Σ�ͼʾ���£�
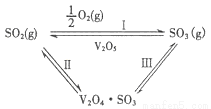
��1�����з�����1mol��ѧ������ʱ��Ҫ���յ������������£�
��ѧ�� | S=O(SO2) | S=O(SO3) | O=O(O2) |
����/kJ | 535 | 472 | 496 |
��ӦI�ġ�H=_______kJ/mol����Ӧ��Ļ�ѧ����ʽΪ__________________��
��2���ӷϷ������л���V2O5�Ĺ������£�

��VO2+���ӿ��ɷ�ͬ��̬�ļ���������ȫˮ��õ�����ˮ�ⷴӦ�����ӷ���ʽ_________��
�ڡ�������ʱΪʹ��Ԫ�صij����ʴﵽ98%������Ӧ������Һ�е�c(NH4+)Ϊ________[25�棬Ksp(NH4VO3) =1.6��10-3����Һ����仯���Բ���]��
��3��������������������ͬʱ����SO2��NOx�����(NH4)2SO4��ϡ��Һ��
�������Һϡ��Һ���ټ�������(NH4)2SO4���壬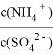 ��_______�����������䡱��С������
��_______�����������䡱��С������
�ڳ����£�0.05mol/L(NH4)2SO4��Һ��pH=a,��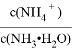 =_______���ú�a�Ĵ���ʽ��ʾ��NH3��H2O��Kb=1.7��10-5��
=_______���ú�a�Ĵ���ʽ��ʾ��NH3��H2O��Kb=1.7��10-5��
 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д� Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��ˮ�и߶���ѧ�ڿ�ѧ���ԣ�������ҵ��⣩��ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����и���������ָ����Һ��һ���ܴ���������ǣ�������
A. ��ˮ�����H+����Ũ�ȵ���10��12mol/L����Һ�У�Na+��K+��NO3����HCO3��
B. pH=1����Һ�У�Fe2+��NO3����SO42����Na+
C. �ӷ�̪�ʺ�ɫ����Һ�У�CO32����Cl����F����NH4+
D. c��H+��/C��OH����=1012����Һ�У�NH4+��NO3����Cl����Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡׯ���и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ��д��ȷ���ǣ� ��
A. ��������ˮ��Cl2+H2O��Cl��+ClO��+2H��
B. �����Ƽ���ϡ�����У�Na +2H��=Na��+ H2��
C. ������Һ�м�������Ba(OH)2��Һ��SO42��+Al3��+Ba2��+4OH����AlO2��+BaSO4��+2H2O
D. ����ϡ������Ȼ�������Һ��ͨ��������4Fe2++O2+4H+�T4 Fe3++2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ����2�·�ģ���������ۻ�ѧ�Ծ��������棩 ���ͣ������
���Ӽ��ܵ����������ڰ뵼�幤ҵ�͵����մɵ�������һ�ִ��Ⱥܸߵ�������ִӷ��ϣ���Co3O4��Al��Si��Li2O��Fe2O3�����ʣ����ᴿ���Ӽ��ܵ�������乤ҵ��ȡ�������£�
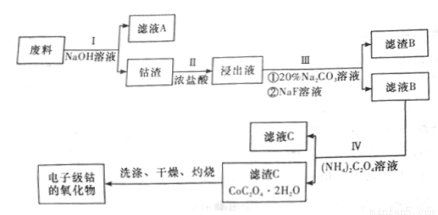
��֪��
�����ʵ��ܽ��ԣ�LiF������ˮ��Li2CO3����ˮ������Ԫ�س����Ļ��ϼ�Ϊ+ 2��+ 3��
�۲��ֽ��������γ��������������pH���±���
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH����ʼ������ | 1.9 | 7.15 | ��0.23 | 3.4 |
pH����ȫ������ | 3.2 | 9.15 | 1.09 | 4.7 |
��1�������ڴ���ǰҪ���飬����ҪĿ���ǣ��ش��������棩___________��
����I�õ�����ҺA�е�����Ϊ___________���ѧʽ����
��2������II���л���ɫ�������ɣ��йغ��ܻ��������Ӧ�����ӷ���ʽΪ_________��
��3������III��Na2CO3��Һ�������ǵ�����Һ��pH��Ӧʹ��Һ��pH��ȡֵ��ΧΪ___________������B����Ҫ�ɷ�Ϊ____________��
��4������I��III��IV�о��õ��ķ����ᴿ����Ϊ_______����ʵ��������ɸò����õ��IJ���������__��
��5��5.49gCoC2O4��2H2O������Է�������Ϊ183����������ϴ�ӡ�����������գ������ط������±���
�¶ȷ�Χ/�� | ��������/g |
150��210 | 4.41 |
290��320 | 2.25 |
400��500 | 2.41 |
290�桫320��ʱ�������������壬������Ӧ�Ļ�ѧ����ʽΪ___________��400�桫500�����ù���Ļ�ѧʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ����2�·�ģ���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���������
A. ������������ͯʳƷ�ĸ�������ڰ�ȫ����
B. ���ع��͡������ӹ��������������Ʒ������������
C. �������������彡�����Σ�����������͡������ķ�ɢ��������ͬ
D. ��ɫ��ѧ�ĺ��������û�ѧԭ���Ի�����Ⱦ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ɽ��ʡ�Ͳ��и�����һ��ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ����
A. NH4+��Al3+��Cl-��HCO3-����Һ���ܴ�������
B. H2O2�ĵ���ʽ�ǣ�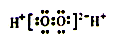
C. AlCl3��Һ�м�������İ�ˮ��Al3����3NH3��H2O��Al(OH)3����3NH4+
D. �����ǻ��������Fe2O3��nH2O��2<n<3����ʾ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�γ��и߶�ѧҵˮƽģ�⣨һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��W��ԭ��������������Ķ���������Ԫ�ء�Y��Wͬ���壬Z���ڵ�������������������X��Y����������֮��Ϊ7��X��Zԭ�ӵĵ������ܺ���Y��Wԭ�ӵĵ������ܺ�֮��Ϊ7��12������˵����ȷ����(����)
A. ԭ�Ӱ뾶��r(X)<r(Y)<r(Z)<r(W)
B. Y�ļ���̬�⻯������ȶ��Ա�W����
C. ��X��Y��ɵ���������Y��W��ɵ����ʻ��ϣ����ܷ���������ԭ��Ӧ
D. �����£�Z�ĵ���һ����������X��Y��W����Ԫ����ɵĻ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�γ��и߶�ѧҵˮƽģ�⣨һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
���������мȺ������Ӽ��ֺ��й��ۼ�����(����)
A. NH4Cl B. NaCl C. H2O D. Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ�����и�����һ��ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ������
��������Ľ������ϡ������γ�[Fe(H2NCONH2)6](NO3)3�������������غ�����III���� ��Fe(CO)x�ȶ�������
��1����̬Fe3+�ĺ�������Ų�ʽΪ_____����NO3-��Ϊ�ȵ�����ķ�����__________��
��2������(H2NCONH2)������C��Nԭ�ӵ��ӻ���ʽ����Ϊ______��C��N��O����Ԫ�صĵ�һ�������ɴ�С��˳����______��
��3�������Fe(CO)x������ԭ�Ӽ۵������������ṩ������֮��Ϊ18����x=______��Fe(CO)x�����³�Һ̬���۵�Ϊ-20 .5 �棬�е�Ϊ103 �棬�����ڷǼ����ܼ����ݴ˿��ж�Fe(CO)x��������_______��������ͣ���
��4�����Цġ��á�a����ͬ�������壬�ġ��á�a���־�������ԭ�ӵ���λ��֮��Ϊ_______��
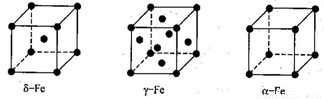
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com