
分析 ①盐酸的酸性强于碳酸,可利用碳酸钙与盐酸反应生成二氧化碳、氯化钙、水;
②利用Zn与稀硫酸反应生成硫酸锌、氢气;
③可溶性铜盐与强碱反应生成氢氧化铜.
解答 解:①利用碳酸钙与盐酸反应生成二氧化碳、氯化钙、水,离子反应为:CaCO3+2H+═Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
②利用Zn与稀硫酸反应生成硫酸锌、氢气,离子反应为:Zn+2H+═H2↑+Zn2+,
故答案为:Zn+2H+═H2↑+Zn2+;
③可溶性铜盐与强碱反应生成氢氧化铜、如CuSO4、Ba(OH)2之间的反应,该反应为CuSO4+Ba(OH)2═Cu(OH)2↓+BaSO4↓,离子反应为:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓,
故答案为:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重常见气体的制取、离子反应意义的考查,注意答案不唯一,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:实验题
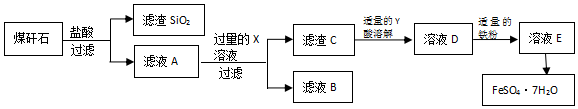
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,由水电离出c(OH-)=1×10-12 mol•L-1的溶液中:K+、HCO3-、Na+、Cl- | |
| B. | 含有0.1 mol•L-1 Fe2+的溶液中:NH4+、SO42-、H+、NO3- | |
| C. | 使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 室温下,pH=1的溶液中:Na+、Cl-、K+、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体都约是22.4L | |
| B. | 1mol气态物质,当体积约为22.4L时,该气体一定处于标准状况下 | |
| C. | 在标准状况下,2mol酒精(CH3CH2OH)的体积为44.8L | |
| D. | 常温常压下,质量为32g的O2含有的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在卤代烃中直接加入稀硝酸酸化的AgNO3溶液,产生白色沉淀 | |
| B. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液,产生白色沉淀 | |
| C. | 加蒸馏水,充分搅拌后,加入AgNO3溶液,产生白色沉淀 | |
| D. | 加入NaOH溶液,加热一段时间后冷却,加入稀硝酸酸化,然后加入AgNO3溶液,产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
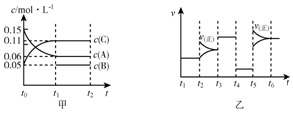 向某密闭容器中加入0.15mol/A、0.05mol/LC和一量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05mol/L].乙图中t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.
向某密闭容器中加入0.15mol/A、0.05mol/LC和一量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05mol/L].乙图中t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.| T1~t2 | T3~t4 | T4~t5 | T6~t |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | 含元素R的某种盐可作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
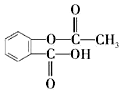
| A. | 乙酰水杨酸的分子式为C9H10O4 | |
| B. | 1mol乙酰水杨酸能与5molH2发生加成反应 | |
| C. | 1mol乙酰水杨酸在NaOH溶液中能与3mol NaOH反应 | |
| D. | 用烃基(-C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com