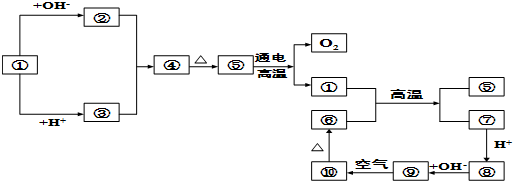
解:①能和酸、碱反应,能和酸和碱反应的物质有铝、氧化铝、氢氧化铝和弱酸的铵盐等,和碱反应生成②,和酸反应生成③,②③反应生成④,加热④生成⑤,电解⑤得①和氧气,所以⑤是氧化物,则④是氢氧化物,①-⑤分别含有同一种元素,所以①是铝,②是偏铝酸盐,③是铝离子,④是氢氧化铝,⑤是氧化铝;高温下铝和金属氧化物发生铝热反应生成氧化铝和金属单质,所以⑦是金属单质,金属单质和酸反应生成盐,盐和氢氧根离子反应生成⑨,⑨和氧气反应生成⑩,加热⑩又生成⑥,能和氧气反应的含有氢氧根离子的物质是氢氧化亚铁,所以⑨是氢氧化亚铁,⑩是氢氧化铁,⑥是氧化铁,⑦是铁,⑧是亚铁盐.
(1)通过以上分析知,①是Al,⑤是Al
2O
3,⑧是Fe
2+;
故答案为:Al、Al
2O
3、Fe
2+;
(2)铝和强碱反应生成偏铝酸盐和氢气,离子方程式为2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑;高温条件下,铝和氧化铁反应生成氧化铝和铁,反应方程式为2Al+Fe
2O
3 
2Fe+Al
2O
3;
故答案为:2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑;2Al+Fe
2O
3 
2Fe+Al
2O
3.
分析:①能和酸、碱反应,能和酸和碱反应的物质有铝、氧化铝、氢氧化铝和弱酸的铵盐等,和碱反应生成②,和酸反应生成③,②③反应生成④,加热④生成⑤,电解⑤得①和氧气,所以⑤是氧化物,则④是氢氧化物,①-⑤分别含有同一种元素,所以①是铝,②是偏铝酸盐,③是铝离子,④是氢氧化铝,⑤是氧化铝;高温下铝和金属氧化物发生铝热反应生成氧化铝和金属单质,所以⑦是金属单质,金属单质和酸反应生成盐,盐和氢氧根离子反应生成⑨,⑨和氧气反应生成⑩,加热⑩又生成⑥,能和氧气反应的含有氢氧根离子的物质是氢氧化亚铁,所以⑨是氢氧化亚铁,⑩是氢氧化铁,⑥是氧化铁,⑦是铁,⑧是亚铁盐.
点评:本题以元素化合物的推断为载体考查了元素化合物的性质,同时考查了学生的推理、分析、判断能力,能正确推断元素化合物是解本题的关键,注意写铝和强碱反应方程式中水参加反应,为易错点.

 ______.
______. 2Fe+Al2O3;
2Fe+Al2O3; 2Fe+Al2O3.
2Fe+Al2O3.

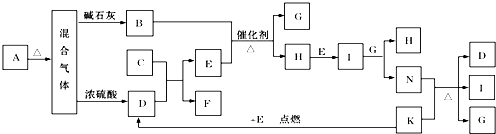
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案





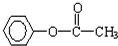 、
、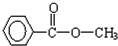 等
等 、
、 等
等








 等
等 等
等 下表是元素周期表的一部分,表中所列字母分别代表十种化学元素,就表中字母所代表的元素回答下列问题.
下表是元素周期表的一部分,表中所列字母分别代表十种化学元素,就表中字母所代表的元素回答下列问题.