
 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.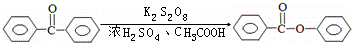
分析 (1)步骤1:乙酸易挥发,浓H2SO4与40mL冰醋酸混合放热;
(2)步骤2:二苯甲酮为有机物,易溶于有机溶剂三氯甲烷,溶于浓硫酸放热,先用电磁搅拌器搅拌4~5分钟,使浓H2SO4、冰醋酸、过硫酸钾充分混合,为控制温度不超过15℃,后将二苯甲酮的三氯甲烷溶液分多次少量加入,并不断搅拌;
(3)步骤3:苯甲酸苯酯易水解,加水不超过1mL,原因是水多了苯甲酸苯酯水解,降低产率,且水和浓硫酸形成溶液放热,导致温度过高,降低产率;
(4)步骤4:抽滤是利用水流使抽滤瓶中的压强降低,达到固液分离的目的,抽滤用到的漏斗名称为布氏漏斗;
(5)浓硫酸具有脱水性,能使有机物脱水碳化,可通过抽滤除去该固体.
解答 解:(1)冰醋酸为纯净的乙酸,易挥发,浓H2SO4与40mL冰醋酸混合放热,步骤1:将20mL浓H2SO4与40mL冰醋酸在下图装置的烧杯中控制在5℃以下混合,防止防止液体溅出,减少冰醋酸的挥发,
故答案为:防止液体溅出,减少冰醋酸的挥发;
(2)步骤2:先用电磁搅拌器搅拌4~5分钟,使浓H2SO4、冰醋酸、过硫酸钾充分混合,得到的溶液主要为无机溶液,二苯甲酮为有机物,易溶于有机溶剂三氯甲烷,将二苯甲酮9.1g溶于三氯甲烷后,形成二苯甲酮的三氯甲烷溶液,浓硫酸密度大,二苯甲酮的三氯甲烷溶液溶于浓H2SO4、冰醋酸、过硫酸钾混合溶液放热,所以为控制温度不超过15℃,向混合液中加入二苯甲酮的三氯甲烷溶液的方法是:多次少量加入,不断搅拌,
故答案为:多次少量加入,不断搅拌;
(3)步骤3:向黄色液体中加水,直至液体黄色消失,加水不超过1mL,否则水多了苯甲酸苯酯水解多,降低产率,且水和浓硫酸形成溶液放热,导致温度过高,降低产率,
故答案为:加水会使苯甲酸苯酯水解,降低产率(或导致温度过高等);
(4)步骤4:减压过滤也称抽滤或吸滤,抽滤用到的漏斗名称为布氏漏斗,
故答案为:布氏漏斗;
(5)整个制备过程中液体混合物会出现褐色固体可能为碳,因为浓硫酸具有脱水性,能将有机物脱水碳化,利用布氏漏斗通过抽滤提纯,
故答案为:在浓硫酸作用下反应物碳化的结果;抽滤.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、混合物分离提纯、有机物的性质为解答的关键,侧重分析与应用能力的考查,注意抽滤为解答的难点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 海水中最丰富的资源是食盐 | |
| B. | 现代社会绝大部分食盐用于食用 | |
| C. | 古代我国就在海滩晒盐,这称为盐田法 | |
| D. | 目前我国海盐年产量名列世界第一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将容器体积变为20 L,Z的平衡浓度变为原来的1/2 | |
| B. | 以X的反应速率为0.001 mol•L-1•s-1 | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 烃被看作有机物的母体,请完成下列与烃的知识相关的练习:
烃被看作有机物的母体,请完成下列与烃的知识相关的练习: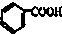 )和碱石灰的混合物得的液体命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式
)和碱石灰的混合物得的液体命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式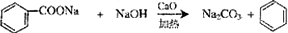

 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛和乙二醛 | |
| B. | 乙醛和丙醛 | |
| C. | 丙醛和苯甲醛 | |
| D. | 只能判断其中有甲醛另一醛无法求得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A中碳原子与氢原子的个数比是1:3,无法确定A中是否含有氧原子 | |
| B. | A的一种同分异构体的结构简式:CH3OCH3 | |
| C. | A物质可以发生消去、取代、加成反应 | |
| D. | A与乙二酸可以通过缩聚反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
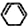
| A. | 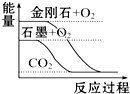 石墨转变为金刚石是吸热反应 | |
| B. | 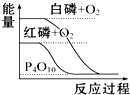 白磷比红磷稳定 | |
| C. | 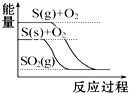 S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 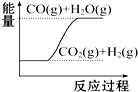 CO(g)+H2O(g)═CO2(g)+H2(g)△H1>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com