
| A、稀释后,溶液中各离子浓度均变小 | ||||
| B、原溶液中,C(Na+)=C(HCO3-)+C(H2CO3)=0.1mol/L | ||||
C、稀释后,溶液中
| ||||
| D、原溶液加入少量NaOH溶液后,其碱性减弱 |
| C(Na+) | ||
C(HC
|
| n(Na+) |
| n(HCO3-) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
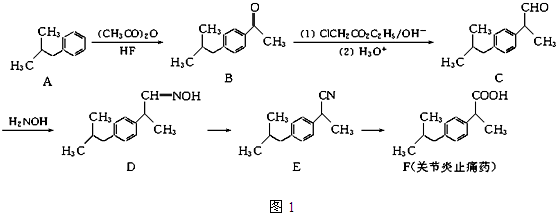
| 浓硫酸 |
| 170℃ |
| Br2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氧酸的酸性:X对应的酸性强于Y对应的酸性 |
| B、第一电离能Y不一定小于X |
| C、X与Y形成化合物时,X显负价,Y显正价 |
| D、Y的气态氢化物的稳定性小于X气态氢化物的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
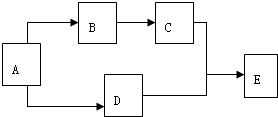 有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示.已知:常温下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体,请回答下列问题:
有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示.已知:常温下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Na2SiO3溶液中通入CO2产生白色胶状沉淀 |
| B、NaOH溶液不能存放在磨口玻璃塞的试剂瓶中 |
| C、二氧化硅溶于水生成硅酸 |
| D、二氧化硅是一种熔沸点很高、硬度很大的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、原硫酸铜溶液的密度为ρ=
| ||
B、原硫酸铜溶液的物质的量浓度为c(CuSO4)=
| ||
C、原硫酸铜溶液的质量分数ω(CuSO4)=
| ||
D、生成硫酸铜晶体的物质的量为
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com