
【题目】有机物X的结构如下,下列有关X的说法正确的是( )
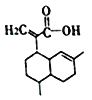
A. X的分子式为C15H24O2
B. 1molX最多可以和3molH2发生加成反应
C. X能发生取代反应和加成反应
D. X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是
A. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
B. 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
【答案】C
【解析】A、根据电离平衡常数知,酸性H2CO3>HCN>HCO3-,结合强酸制取弱酸知,氰化钠溶液中通入少量CO2只能发生以下反应CN﹣+H2O+CO2=HCN+ HCO3-,故A错误;B、NaCN溶液显碱性,HCN溶液显酸性,选项中没有已知混合时NaCN与HCN量的相对大小,无法判断溶液的酸碱性,也无法判断离子浓度大小,故B错误;C、HCN的电离常数K与CN的水解常数Kh的乘积等于Kw,则有Kh=![]() ≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
【题型】单选题
【结束】
19
【题目】室温下,向20.00 mL 0.8molL﹣1一元酸HA溶液中滴入0.8 molL﹣1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
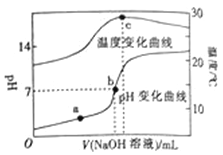
A. 常温下,1.0 molL﹣1HA的溶液的pH=0
B. a、b、c三点,a点混合溶液中c(Na+)最大
C. a、b两点的溶液中水的离子积Kw(a)=Kw(b)
D. c点时消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
A. C2H4、C2H6O B. C2H6、C2H6O C. C3H6、C2H4 D. C3H4、C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的图解表示构成细胞的元素、化合物及其作用,a.b.c.d代表不同的小分子物质,A.B.C代表不同的大分子,请分析回答下列问题:
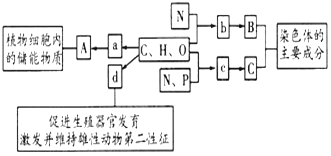
(1)物质a是_______,在动物细胞内,与物质A作用最相近的物质是_______。若物质A在动物、植物细胞均可含有,并作为细胞内的最理想的储存能量的物质,不仅能量多而且体积较小,则A是_________。
(2)物质d是________,化学本质是一种_________。同属于此类的还有胆固醇,其作用是构成__________的重要成分,在人体内还参与_______运输。
(3)物质b是________,若某种B分子含有2条链,由18个b分子(平均相对分子质量为128)组成的组成,则该B分子的相对分子质量大约为__________。
(4)物质c在人体细胞中共有_____种,分子中__________不同,决定了c的种类不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 位于同一周期,下列关系正确的是
位于同一周期,下列关系正确的是
A. 还原性:As3->S2->Cl-
B. 热稳定性:HCl>AsH3>HBr
C. 原子半径:As>Cl>P
D. 酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CN-可以造成水体污染,某小组采用如下方法对污水进行处理。
Ⅰ![]() 双氧水氧化法除NaCN。
双氧水氧化法除NaCN。
(1)NaCN的电子式为____________________________。
(2)碱性条件下加入双氧水除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为________________。
Ⅱ.CN-和Cr2O72-联合废水处理法。
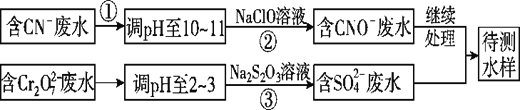
(3)②中反应后无气体放出,该反应的离子方程式为_____________________。
(4)步骤③中,每处理0.4mol Cr2O72-,至少消耗Na2S2O3________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2001年诺贝尔化学奖授予"手性碳原子的催化氢化,氧化反应"研究领域作出贡献的美,日三位科学家,手性分子具有镜像异构及光学活性,下列分子中具有光学活性的是
A.CBr2F2 B.CH3CH2OH
C.CH3CH2CH3 D.CH3CH(OH)COOH。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com