
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1 817 | 2 745 | 11 578 |
| Y | 738 | 1 451 | 7 733 | 10 540 |
| Z | 496 | 4 562 | 6 912 | 9 543 |
 .
. 分析 (1)X、Y、Z为第三周期元素,X的I4电离能突然增大,说明最外层有3个电子,则X应为Al,Y的I3电离能突然增大,说明最外层有2个电子,则Y应为Mg,Z的I2电离能突然增大,说明最外层有1个电子,则Z应为Na,同周期元素从左到右元素的电负性逐渐增强,Mg价电子排布式为3s2完全充满状态,比Al稳定,所以Mg的第一电离能大于Al;
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成XYn型电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化,则A、B、C、D分别为碳、氮、氧、氢,M为CH4、N为NH3、W为H2O.
①同周期随原子序数增大,第一电离能呈增大趋势,N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
②同种元素之间形成非极性共价键,不同元素之间形成极性共价键,甲烷分子为正四面体构型,分子中正负电荷重心重合;
③氨分子间存在氢键;
④W为H2O,计算O原子价层电子对数、孤电子对数,确定VSEPR模型的空间构型、分子的空间构型;
⑤CN-离子中和N2分子中含有三键,三键有2个π键;
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1,则E为K、F为Cr、G为Cu.
解答 解:(1)X、Y、Z为第三周期元素,X的I4电离能突然增大,说明最外层有3个电子,则X应为Al,Y的I3电离能突然增大,说明最外层有2个电子,则Y应为Mg,Z的I2电离能突然增大,说明最外层有1个电子,则Z应为Na,
同周期元素从左到右电负性逐渐增强,则X、Y、Z的电负性从大到小的顺序为Al>Mg>Na,因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定,所以Mg的第一电离能大于Al,
故答案为:Al>Mg>Na;因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定;
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成XYn型电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化,则A、B、C、D分别为碳、氮、氧、氢,M为CH4、N为NH3、W为H2O.
①同周期随原子序数增大,第一电离能呈增大趋势,N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:C<O<N,故答案为:C<O<N;
②M为甲烷,甲烷含有C-H极性共价键,分子构型为正四面体,分子中正负电荷重心重合,属于非极性分子,故答案为:极性;非极性;
③N为氨,因为氨分子间存在氢键,因而易液化,故答案为:氨分子间存在氢键,因而易液化;
④W为H2O,中心原子氧原子含有孤对电子为$\frac{6-1×2}{2}$=2、价层电子对数为4,故水分子的VSEPR模型的空间构型为四面体,水分子的空间构型为V形,故答案为:四面体型;V形;
⑤CN-离子和N2分子中均含有三键,π键数目比为2:2=1:1,故答案为:1:1;
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1,则E为K、F为Cr、G为Cu.
①铬元素的价电子排布式为3d54s1,故其化合物中最高化合价为+6价,故答案为:+6;
②Cu2+离子的核外电子排布式为1s22s22p63s23p63d9,Cu2+和NH3分子形成的配离子为[Cu(NH3)4]2+,其结构式为 ,
,
故答案为:1s22s22p63s23p63d9; .
.
点评 本题是对物质结构的考查,涉及电离能、电负性、化学键、氢键、分子构型、核外电子排布、配合物等,题目难度中等,需要学生具备扎实的基础.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.
短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.
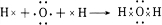 ,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mo1•L-1 | |
| B. | 标准状况下,22.4L水所含的分子数为NA | |
| C. | 常温常压下NO2和N2O4混合气体22.4L,其中含有的原子总数为0.3NA | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键是原子轨道以“头碰头”的方式相互重叠 | |
| B. | 共价化合物分子的键能越大,键长越长,则分子越稳定 | |
| C. | 2个原子形成多个共价键中,只有一个σ键,而π键可以是一个或多个 | |
| D. | 形成共价键时键与键重叠程度越大,体系能量越底,键越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大容器的容积 | B. | 再充入一定量的N2O4 | ||
| C. | 分离出一定量的NO2 | D. | 再充入一定量的He |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .该物质属于共价化合物(填“离子”或“共价”).向X的水溶液中滴加石蕊溶液,会观察到:溶液变红色.并用方程式解释原因NH3+H2O=NH3.H2O?NH4++OH-.
.该物质属于共价化合物(填“离子”或“共价”).向X的水溶液中滴加石蕊溶液,会观察到:溶液变红色.并用方程式解释原因NH3+H2O=NH3.H2O?NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 罗伯特•洛夫科维茨 | B. | 丹•谢赫特曼 | ||
| C. | 理查德•赫克 | D. | 托马斯•施泰茨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据某种原子的质量数可以确定该元素的相对原子质量 | |
| B. | H-N=C=O与H-O-C≡N互为同分异构体 | |
| C. | 化学键存在于化合物中,也可能存在于单质中 | |
| D. | 35Cl与37Cl是两种不同的核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com