
| ʵ����� | ����ˮ����� | KI��Һ����� | ���ĵ�Na2S2O3��Һ����� |
| 1 | 10.00mL | 10.00mL | 19.96mL |
| 2 | 10.00mL | 10.00mL | 20.04mL |
���� ��1��Na2S2O3��I2��Ӧ��I2����ԭΪI-��S2O32-������ΪS4O62-��д�����ӷ���ʽ��I2+2S2O32-=2I-+S4O62-��
��2���ζ���ʹ�õ�ָʾ���ǵ�����Һ�����ⷴӦ��ȫʱ����Һ����ɫǡ�ñ�Ϊ��ɫ�Ұ�����ڲ��ָ���
��3���������ӷ���ʽ��I2+2S2O32-=2I-+S4O62-��Cl2+2I-=I2+2Cl-��֪��ϵʽ��Cl2��I2��2S2O32-����n��Cl2�������c��Cl2����
��4��ʵ���е���ƿ������ˮϴ����δ������ˮϴ�ӣ�����ʹ����ˮ�������ӣ���õ�ʵ��ֵ����ʵ��ֵ��
��� �⣺��1��Na2S2O3��I2��Ӧ��I2����ԭΪI-��S2O32-������ΪS4O62-��д�����ӷ���ʽ��I2+2S2O32-=2I-+S4O62-��
�ʴ�Ϊ��I2+2S2O32-=2I-+S4O62-��
��2���ζ���ʹ�õ�ָʾ���ǵ�����Һ�����ⷴӦ��ȫʱ����Һ����ɫǡ�ñ�Ϊ��ɫ�Ұ�����ڲ��ָ����ﵽ�յ㣬
�ʴ�Ϊ��������Һ����ɫ��Һǡ�ñ�Ϊ��ɫ�Ұ�����ڲ��ָ���
��3���������ӷ���ʽ��I2+2S2O32-=2I-+S4O62-��Cl2+2I-=I2+2Cl-��֪��ϵʽ��Cl2��I2��2S2O32-��
���ĵ�Na2S2O3��Һ�����Ϊ����19.96mL+20.04mL����2=20.00mL��v��Na2S2O3��=20.00 mL��c��Na2S2O3��=0.0010mol•L-1��
��n��S2O32-��=c��Na2S2O3����v��Na2S2O3��=0.0010mol•L-1��20.00��10-3 L=2��10-5 mol��
����Cl2��I2��2S2O32-��n��Cl2��=1��10-5 mol��
c��Cl2��=$\frac{n��C{l}_{2}��}{V������ˮ��}$=1��10-5 mol�£�10.00��10-3 L��=0.0010 mol•L-1��
�ʴ�Ϊ��0.0010 mol•L-1��
��4��ʵ���е���ƿ������ˮϴ����δ������ˮϴ�ӣ�����ʹ����ˮ�������ӣ���õ�ʵ��ֵ����ʵ��ֵ��
�ʴ�Ϊ�����ڣ�
���� ���⿼����������ԭ�ζ���ָʾ����ʹ�á��ζ��յ���жϣ��ζ�����ʱҪע���ù�ϵʽ�����Ŀ�Ѷ����У�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ɷ� | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| ����/mg•L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
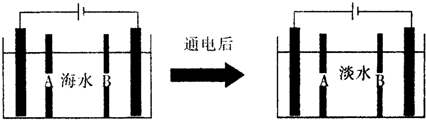
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ڢ� | C�� | �٢ڢ� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �߷��ӷ���Ĥ | B�� | �����۾� | C�� | ����˿ | D�� | ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
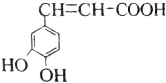
| A�� | ��÷����廯�������ʽ��ͬ�����������༰��Ŀ����ͬ�ұ����ϵ�һ�ȴ���ֻ�����ֵ��л���Ľṹ��4�֣������ǿռ��칹�� | |
| B�� | ������ֻ�ܼӾ۳ɸ߷��ӻ����� | |
| C�� | ������������5mol���������ӳɷ�Ӧ | |
| D�� | 1mol��������������Na2CO3��Һ��Ӧ��������3molCO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
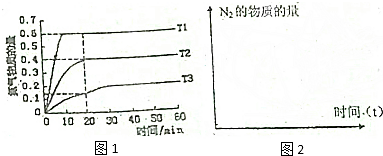
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
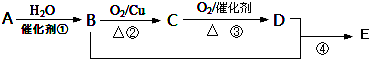
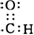 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ױ� | B�� | ���� | C�� | һ�ȶ�ϩ | D�� | ���ȱ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C20H30O2��C22H30O2 | B�� | C22H32O2��C20H30O2 | ||
| C�� | C22H30O2��C20H30O2 | D�� | C20H30O2��C22H32O2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com