
| A. | 乙酸的分子式:CH3COOH | B. | 甲烷的结构简式:CH4 | ||
| C. | 35Cl表示该氯原子核内有20个中子 | D. | SiO2是二氧化硅的分子式 |
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H${\;}_{2}^{16}$O、D${\;}_{2}^{16}$O、H${\;}_{2}^{18}$O、D${\;}_{2}^{18}$O互为同位素 | |
| B. | 金刚石、石墨均为碳的同素异形体,其化学性质与物理性质均相似 | |
| C. | 石墨烯(结构如图 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 | |
| D. | 由于氢原子可以形成H-(如NaH),所以有人建议可将氢元素排在元素周期表的ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰中的分子间作用力和单质碘中的分子间作用力 | |
| B. | CsCl晶体中与一个Cl-紧邻的Cs+数和NaCl晶体中与一个Cl-紧邻的Na+数 | |
| C. | 晶体硅中Si-Si键的键能和金刚石中C-C键的键能 | |
| D. | 水分子中O-H键的键角和甲烷分子中C-H键的键角 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
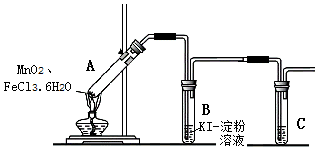
| 操作 | 现象 |
| (1)经检查,装置气密性良好. (2)添加药品,连接装置. (3)点燃酒精灯. | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当0<b<$\frac{a}{3}$时:SO2+H2O+3ClO-=SO42-+2HClO+Cl- | |
| B. | 当b=a时,SO2+H2O+ClO-═2H++Cl-+SO42- | |
| C. | 当$\frac{a}{3}$≤b≤a时,反应后溶液中H+的物质的量:0<n(H+)≤2bmol | |
| D. | 当0<b<a时,反应后溶液中ClO-、Cl-和SO42-物质的量之比为:(a-b):b:b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com