
| 2×10-11 |
| 0.1 |


科目:高中化学 来源: 题型:
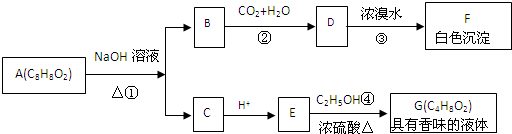
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| A、体系的压强不再发生变化 |
| B、生成nmolCO的同时生成n molH2 |
| C、v正(CO)=v逆(H2O) |
| D、1molH-H键断裂的同时2molH-O键断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
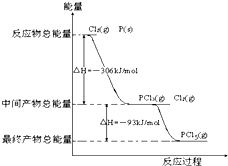 红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COOH)>c(CH3COO-) |
| C、2c(H+)=c(CH3COO-)-c(CH3COOH) |
| D、c(CH3COOH)+c(CH3COO-)=0.02mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9:1 | B、1:11 |
| C、1:9 | D、11:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其他条件不变,温度的升高,纯水的pH不变 |
| B、其他条件不变,加水稀释后,碳酸钠溶液的c(H+)减小 |
| C、其他条件不变,温度的升高,碳酸溶液的c(H+)基本不变 |
| D、其他条件不变,常温pH=5的盐酸稀释1000倍后,溶液的pH变为8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com