
分析 (1)当溶液中有大量H+存在时,与H+反应的离子不能大量存在;
(2)若加入Ba(NO3)2溶液后不生成沉淀,说明不含含有SO42-、SO32-、CO32-;
(3)根据硫酸钡不溶于水、酸的性质判断.
解答 解:(1)当溶液中有大量H+存在时,SO32-、CO32-与H+反应生成气体而不能大量存在,故答案为:CO32-、SO32-;
(2)因SO42-、SO32-、CO32-与Ba2+分别反应生成沉淀,则若加入Ba(NO3)2溶液后不生成沉淀,说明不含含有SO42-、SO32-、CO32-,
故答案为:SO42-、SO32-、CO32-;
(3)碳酸钡、亚硫酸钡都溶于盐酸,加入盐酸和BaCl2的混和溶液,有大量的白色沉淀生成,说明沉淀为硫酸钡,则含有SO42-,故答案为:SO42-.
点评 本题考查了离子共存的判断,题目难度不大,试题侧重基础知识的考查,注意掌握离子反应发生条件,明确离子能否共存的判断方法.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:解答题
 △H=+88.6kJ•mol-1则M、N相比,较稳定的是M.
△H=+88.6kJ•mol-1则M、N相比,较稳定的是M.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用淀粉溶液检验溶液中是否存在碘单质 | |
| B. | 用激光笔照射稀豆浆,有丁达尔效应,稀豆浆属于胶体 | |
| C. | 用盐酸溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 用分液漏斗分离水与乙醇的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种难溶盐电解质,其中Ksp小的溶解度一定小 | |
| B. | 溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 | |
| C. | 难溶盐电解质的Ksp与温度有关 | |
| D. | 同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al2(SO4)3 溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | FeSO4 溶液中加入用硫酸酸化的H2O2溶液:Fe2++H2O2+2H+=Fe3++2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强弱电解质的根本区别在于电离时是否存在电离平衡 | |
| B. | 所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质 | |
| C. | 弱电解质的水溶液中只有离子,没有分子 | |
| D. | 强电解质融化状态下都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
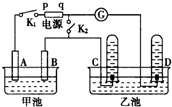 在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 瞬间产生大量高温气体推动航天飞机飞行 | |
| B. | 从能量变化的角度,主要是化学能转变为热能和动能 | |
| C. | 反应的焓变大于零 | |
| D. | 在方程式后增加△H及其数值即为热化学方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(H+)随着温度升高而降低 | B. | 在35℃时,C(H+)>C(OH-) | ||
| C. | 水的电离度(25℃)>(35℃) | D. | 水的电离是吸热的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com