
【题目】广东河源市东源县某村土壤的主要成份是Al2O3、Fe3O4及SiO2,广州大学附属东江中学“探险号”化学兴趣小组设计以下流程提取金属铝:
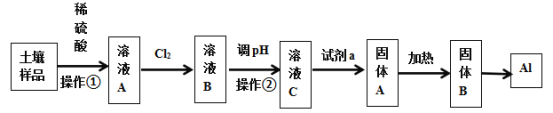
信息提示:氧化铝在电解条件下可得金属铝;Fe(OH)3、Al(OH)3、Fe(OH)2开始沉淀与完全沉淀的pH数据表:
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | |
开始沉淀的pH | 2.7 | 3.3 | 5.9 |
完全沉淀的pH | 3.2 | 5.2 | 8.4 |
(1)溶液A含有的金属阳离子为_________________固体B的化学式为_______________________
(2)步骤中通入氯气时的离子方程式为___________________________________________________
(3)溶液C的pH范围是_____________________,操作②的名称是_________________________
(4)通入试剂a的离子方程式为_________________________________________________________
【答案】Al3+、Fe2+、Fe3+ Al2O3 Cl2 + 2Fe2+ == 2Cl- + 2Fe3+ 3.2≤pH<3.3 过滤 Al3+ + 3NH3·H2O == Al(OH)3↓ + 3NH4+
【解析】
Al2O3与稀硫酸反应生成硫酸铝和水,Fe3O4与稀硫酸反应生成硫酸铁、硫酸亚铁和水,SiO2和稀硫酸不反应,所以溶液A中含有硫酸铝、硫酸铁、硫酸亚铁;溶液A通入氯气,氯气把Fe2+氧化为Fe3+;调节pH除去Fe3+,过滤后,向溶液C中通入氨水,生成氢氧化铝沉淀,过滤,加热氢氧化铝,分解为氧化铝,电解熔融氧化铝生成单质铝。
(1) Al2O3与稀硫酸反应生成硫酸铝和水,Fe3O4与稀硫酸反应生成硫酸铁、硫酸亚铁和水,SiO2和稀硫酸不反应,溶液A中含有硫酸铝、硫酸铁、硫酸亚铁,溶液A含有的金属阳离子为Al3+、Fe2+、Fe3+;固体A是氢氧化铝,加热氢氧化铝,分解为氧化铝,所以固体B是氧化铝,化学式为Al2O3;
(2)通入氯气时,氯气把Fe2+氧化为Fe3+,反应的离子方程式为Cl2 + 2Fe2+ = 2Cl- + 2Fe3+;
(3) 调节pH的目的是除去Fe3+,所以溶液C的pH范围是3.2≤pH<3.3,操作②是分离出氢氧化铁沉淀,操作②的名称是过滤;
(4)通入试剂a的目的是生成氢氧化铝沉淀,试剂a是氨水,反应的离子方程式为Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】科学家将水置于足够强的电场中,在 20℃时水分子瞬间凝固可形成“暖冰”。某兴趣小组做如图所示实验,发现烧杯中酸性 KMnO4 溶液褪色,且有气泡产生。将酸性 KMnO4 溶液换成FeCl3 溶液,烧杯中溶液颜色无变化,但有气泡产生。则下列说法中正确的是

A. 20 ℃时,水凝固形成的“暖冰”所发生的变化是化学变化
B. “暖冰”是水置于足够强的电场中形成的混合物
C. 烧杯中液体为FeCl3 溶液时,产生的气体为Cl2
D. 该条件下H2 燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制造太阳能电池需要高纯度的硅,工业上制取高纯度硅常用以下反应实现:
①Si(s)+3HCl(g)![]() SiHCl3(g)+H2(g)
SiHCl3(g)+H2(g)
②SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)
Si(s)+3HCl(g)
对以上两个反应的下列叙述错误的是( )
A.两个反应都是置换反应
B.反应①所需粗硅可通过反应:SiO2+2C![]() Si+2CO↑来制备
Si+2CO↑来制备
C.两个反应都是氧化还原反应
D.两个反应互为可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):①降低温度______;②增大A的浓度________;③恒容下充入氖气_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产、科技关系密切,下列说法中正确的是( )
A.“碳海绵”吸收泄漏的原油时发生了化学变化
B.“玉兔二号”月球车首次实现在月球背面着陆,其帆板太阳能电池的材料是二氧化硅
C.“嫘祖栽桑蚕吐丝,抽丝织作绣神奇”中的“丝”不耐酸碱
D.氢燃料电池中使用的储氢材料,如稀土类![]() 等合金材料是纯净物
等合金材料是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
请回答钢铁在腐蚀、防护过程中的有关问题。
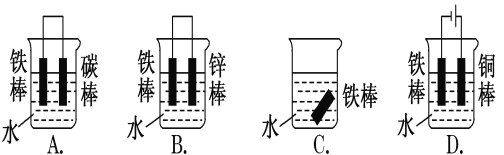
(1)下列哪些装置不能防止铁棒被腐蚀________________;
(2)实际生产可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图.请回答:
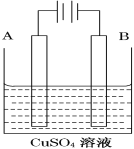
①B电极对应的金属是________(写元素名称),
A电极的电极反应式是___________________。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性条件下使用鸟粪石[Mgx(NH4)y(PO4)z·nH2O]处理氨氮废水具有加热时间短,氨逸出彻底等优点。反应原理如下:
yNa++yOH-+Mgx(NH4)y(PO4)z·nH2O![]() Mgx(Na)y(PO4)z+yNH3↑+(n+y)H2O
Mgx(Na)y(PO4)z+yNH3↑+(n+y)H2O
Mgx(Na)y(PO4)z+y![]() +nH2O
+nH2O![]() yNa++Mgx(NH4)y(PO4)z·nH2O↓
yNa++Mgx(NH4)y(PO4)z·nH2O↓
(1)上述氨氮废水处理过程中鸟粪石所起的作用是__________。
(2)其它条件不变,若鸟粪石化学式中的z保持不变,x越大,处理相同量的氨氮废水所需的时间就_________(填:“越长”“越短”“不变”)。
(3)为测定鸟粪石的组成,进行下列实验:
①取鸟粪石2.45 g与足量的NaOH溶液混合,加热,收集到标准状况下的气体224mL
②另取鸟粪石2.45 g溶于稍过量盐酸,用蒸馏水配成100.00 mL溶液A;
③取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+,滴定至终点,消耗EDTA标准溶液25 mL(已知Mg2+与EDTA反应的化学计量比1∶1);
④取25.00 mL溶液A,加入0.005mol的BiCl3,调节溶液pH生成Mg3(PO4)2和BiPO4沉淀,过滤,滤液中的Bi3+用EDTA标准溶液滴定为![]() mol。通过计算确定鸟粪石的化学式_____________(写出计算过程)。
mol。通过计算确定鸟粪石的化学式_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com