
已知C(s)+CO2(g)═2CO(g)△H>0,反应速率为v1,Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
△H<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
|
| A. | 同时增大 | B. | 同时减小 |
|
| C. | v1增大,v2减小 | D. | v1减小,v2增大 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下面有关晶体的叙述,错误的是( )
A.金刚石的空间立体网状结构中,由共价键形成的最小碳环上有6个碳原子
B.在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个Na+)
C.白磷晶体中,微粒之间通过共价键结合,键角为60°
D.离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
A.至少存在5种离子
B.Cl﹣一定存在,且c(Cl‑)≥0.4mol/L
C.SO42﹣、NH4+、一定存在,Cl﹣可能不存在
D.CO32﹣、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)═zC(g)△H<0.达到化学平衡后测得A的浓度为0.5mol•L﹣1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.9mol•L﹣1.则下列有关判断正确的是( )
|
| A. | 平衡向正反应方向移动了 | B. | x+y<z |
|
| C. | B的转化率下降 | D. | C的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积减小的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
|
| A. | ①④ | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,纯水中c(H+)=2×10﹣7 mol•L﹣1,则此温度下水的离子积为 .若温度不变,滴入稀盐酸使c(H+)=5×10﹣4 mol•L﹣1,则此时c(OH﹣)= .由水电离产生的c(H+)为 ,此时温度 (填“高于”、“低于”或“等于”)25°C.
查看答案和解析>>
科目:高中化学 来源: 题型:
将①H+ ②Cl- ③Al3+ ④K+ ⑤S2- ⑥OH- ⑦NO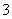 ⑧NH
⑧NH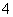 分别加入H2O中,基本上不影响水的电离平衡的是( )
分别加入H2O中,基本上不影响水的电离平衡的是( )
A.①③⑤⑦⑧ B.②④⑦
C.①⑥ D.②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”。某研究性学习小组拟对融雪氯盐(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究。
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
该小组设计流程如图:
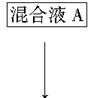



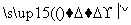

(1)加入混合液A的主要成分是________________(填化学式)。
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入________溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成。下列三种溶液,其沉淀效果最好的是________。
A.0.1mol·L-1 Na2CO3溶液
B.0.1mol·L-1 Na2SO3溶液
C.0.1mol·L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在________________以下。
(4)对溶液B加热并不断滴加6mol·L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C。该操作的目的是__________________________________________________。
(5)溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到有大量固体析出时停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式______________________________。
(2)根据等电子原理,写出CO分子的结构式________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是________;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com