
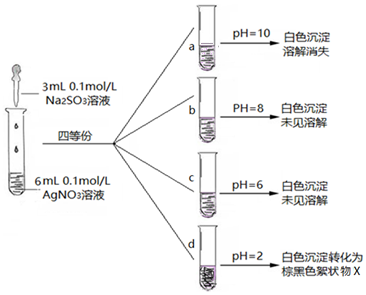
| 实验 | 操作 | 现象 |
| ⅰ | 将其置于试管中加稀盐酸、观察 | 无明显现象 |
| ⅱ | 将其置于试管中加足量浓硝酸、观察 | 立即产生红棕色气体 |
| ⅲ | 在ⅱ反应所得溶液中,加Ba(NO3)2溶液、观察,再加BaCl2、观察 | 前者无明显现象,后者出现白色沉淀 |
分析 (1)①Na2SO3和AgNO3发生复分解反应生成亚硫酸银和硝酸钠,根据资料,产生白色浑浊;
②Ag2O为碱性氧化物和酸反应生成盐和水;
(2)①AgNO3为强酸弱碱盐,在溶液中水解显酸性;
②Na2SO3为强碱弱酸盐,在溶液中水解显碱性;
(3)Ⅰ.Ag2SO3在碱性较强条件下,溶解或Ag2SO3被氧化成Ag2SO4溶解,溶液a中碱性较强,沉淀溶解消失的原因可能是溶解;
Ⅱ.根据b、c、d三次实验对比可知,亚硫酸银在溶液中沉淀析出的大致PH范围是6-8,;
Ⅲ.①实验Ⅰ中沉淀不溶解,而氧化银能溶于盐酸中,所以得到的棕黑色沉淀不是氧化银,
②沉淀能与浓硝酸反应产生红棕色气体,说明具有还原性,反应后加入硝酸钡无明显现象,说明不存在硫酸根离子,再加入氯化钡产生白色沉淀,白色沉淀为氯化银,所以d 中的棕黑色絮状物X是银;
③实验Ⅱ中的化学反应为银和硝酸的反应,银和硝酸反应生成硝酸银、二氧化氮、水;
(4)根据以上分析可知在酸性条件下,亚硫酸根离子的还原性增强,+4价硫的亚硫酸银,被+1价银氧化生成银和硫酸.
解答 解:(1)①Na2SO3和AgNO3发生复分解反应:Na2SO3+AgNO3=Ag2SO3↓+NaNO3,根据资料Ag2SO3:白色、难溶于水,所以现象为:产生白色浑浊,
故答案为:产生白色浑浊;
②Ag2O为碱性氧化物,和盐酸反应生成氯化银和水,反应为:Ag2O+2HCl=2AgCl+H2O,
故答案为:Ag2O+2HCl=2AgCl+H2O;
(2)①AgNO3为强酸弱碱盐,在溶液中pH=5,其水解离子方程为:Ag++H2O?H++AgOH,
故答案为:Ag+;
②Na2SO3为强碱弱酸盐,在溶液中水解显碱性,则溶液的pH=10,其水解离子方程为:SO32-+H2O?HSO3-+OH-,
故答案为:SO32-+H2O=HSO3-+OH-;
(3)Ⅰ.溶液a中PH=10,碱性较强,沉淀溶解消失的原因可能是Ag2SO3在碱性较强条件下,溶解或Ag2SO3被氧化成Ag2SO4溶解,
故答案为:Ag2SO3在碱性较强条件下,溶解或Ag2SO3被氧化成Ag2SO4溶解;
Ⅱ.b试管中PH=8、c试管中PH=6、d试管中PH=2,d试管中,白色沉淀转化为棕黑色的沉淀X,由三次实验对比可知,亚硫酸银在溶液中沉淀析出的大致PH范围是6-8,
故答案为:6-8;
Ⅲ.①氧化银能和盐酸生成白色氯化银沉淀和水,溶液的pH=2,产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X,向X中滴加稀盐酸,无明显变化,说明X不是Ag2O,
故答案为:Ag2O;
②沉淀能与浓硝酸反应产生红棕色气体,说明具有还原性,反应后加入硝酸钡无明显现象,说明不存在硫酸根离子,再加入氯化钡产生白色沉淀,白色沉淀为氯化银,所以向X中加入过量浓HNO3,产生红棕色气体为NO2,X与浓硝酸发生氧化还原反应,X只能为金属单质,只能为银,
故答案为:Ag;
③向X中加入过量浓HNO3,产生红棕色气体为NO2,银和硝酸反应,氮元素从+5变为+4价,同时生成硝酸银和水,反应为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O,
故答案为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O;
(4)X为Ag,白色沉淀转化为X,为在酸性条件下,亚硫酸银中+4价的硫,被+1价银氧化,生成银和硫酸,反应为:Ag2SO3+H2O=2Ag+H2SO4,
故答案为:还原;Ag2SO3+H2O=2Ag+H2SO4.
点评 本题考查了盐的水解原理的应用、氧化还原反应等知识,侧重于学生的分析能力的考查,掌握硫、氮及其化合物的性质是解答的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有12mol σ键 | |
| B. | Z的最高价含氧酸分子中,羟基氧和非羟基氧个数比为1:1 | |
| C. | Y的气态氢化物分子中H-Y-H键角比Y的最高价氧化物分子中O-Y-O键角小 | |
| D. | Z的气态氢化物比Y的气态氢化物稳定,是因为氢键的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
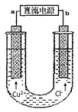
| A. | a端是直流电源的负极 | |
| B. | 通电使CuCl2发生电离 | |
| C. | 阴极上发生的反应:Cu2++2e-=Cu | |
| D. | 通电后,在阳极附近可观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳是酸雨的主要成分 | |
| B. | 氢气是一种理想的清洁燃料 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 氯化铁溶液可用于制作印刷铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基和烃基直接相连接的化合物一定属于醇类 | |
| B. | 分子内有苯环和羟基的化合物一定是酚类 | |
| C. | 醇类的官能团是跟烃基(除苯环外)的碳原子相连的羟基 | |
| D. | 醇类和酚类具有相同的官能团,因而具有相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
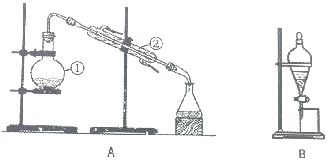 如图装置是实验室中物质分离的常用装置,请回答下列问题.
如图装置是实验室中物质分离的常用装置,请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com