
 (1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系 .
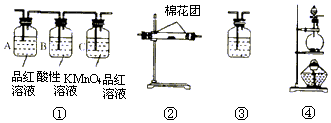
.分析 碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫气体和水,先用无水硫酸铜检验水的存在,再通过品红溶液检验二氧化硫的存在,再通过酸性高锰酸钾除去二氧化硫,再通过品红溶液检验二氧化硫是否除尽,最后通过澄清石灰水检验二氧化碳存在,据此解答.
解答 解:(1)碳与浓硫酸反应生成生成二氧化硫、二氧化碳和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,电子转移情况 ,
,
故答案为: ;
;
(2)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫气体和水,先用无水硫酸铜检验水的存在,再通过品红溶液检验二氧化硫的存在,再通过酸性高锰酸钾除去二氧化硫,再通过品红溶液检验二氧化硫是否除尽,最后通过澄清石灰水检验二氧化碳存在,所以正确的顺序为:④②①③;
故答案为:④②①③;
(3)A品红溶液用于检验二氧化硫气体;检验二氧化碳前必须确保混合气体中不含二氧化硫,所以B中酸性高锰酸钾溶液用于除去二氧化硫,C中品红溶液用于检验二氧化硫是否已经除尽;
故答案为:验证SO2的存在; 充分吸收SO2;验证SO2是否已被吸收完全;
(4)无水硫酸铜用于检验水的存在情况,由于产物通过①③时会带出水蒸气,所以②必须放在①、③之前;
故答案为:无水硫酸铜;水;由于产物通过①③时会带出水蒸气,所以②必须放在①、③之前;
(5)二氧化硫除尽后,剩余气体通入澄清石灰水,若石灰水变浑浊说明含义二氧化碳;
故答案为:澄清的石灰水;CO2.
点评 本题考查了浓硫酸与碳反应产物的判断,明确浓硫酸的性质及发生反应实质是解题关键,注意明确检验二氧化碳的存在时,需要排除二氧化硫的干扰,试题培养了学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
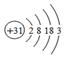 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH)3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和机物中碳原子不能发生化学反应 | |
| B. | C原子只能与C原子形成不饱和键 | |
| C. | 任何有机物中H原子数目不可能为奇数 | |
| D. | 五个C原子之间能够形成五个碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
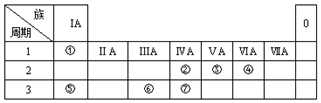
 ,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
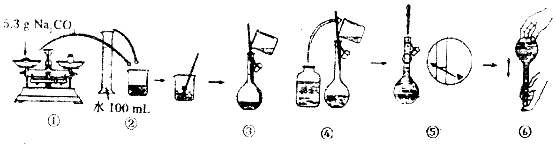
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 672 mL | B. | 168 mL | C. | 504 mL | D. | 224 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com