
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g) 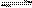 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 2 min末浓度/mol·L-1 | 0.08 | a | b |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y) = 0.03 mol·L-1·min-1
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
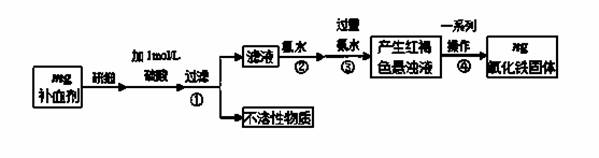
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要 。
(2)步骤②加入过量氯水后发生反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 _______________溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有 性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是 。
A.KSCN溶液 B.酸性KMnO4溶液 C.铁粉 D.FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,两个恒容密闭容器中分别发生下列两个反应:①H2(g)+I2(g) 2HI(g) ②C(s)+H2O(g)
2HI(g) ②C(s)+H2O(g) CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
a. 各物质的浓度不变 b. 容器内气体压强不变
c. 容器内气体密度不变 d. 容器内气体颜色不变
e. 各组分的物质的量分数或质量分数不变
A. abc B. ade C. ae D. ac
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H2C2O4 + H+ —— Mn2+ + CO2↑+ H2O(未配平)
Ⅰ.甲同学研究外界因素对反应速率影响,设计如下实验方案:
用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| A | 2 mL | 20 | |
| B | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| C | 2 mL | 30 | |
| D | 1 mL | 20 | V1 mL蒸馏水 |
| E | 0.5 mL | 20 | V2 mL蒸馏水 |
(1)完成上述实验方案设计,其中: V1= ,V2= ;
(2) 如果研究温度对化学反应速率的影响,使用实验 和 。
(3) 甲同学在做A组实验时,发现反应开始时速率较慢,随后加快。他分析认为高锰酸钾与
草酸溶液的反应放热,导致溶液温度升高,反应速率加快;从影响化学反应速率的因素看,
你猜想还可能是 ;
Ⅱ.乙同学利用下图测定反应速率

回答下列问题
(4)实验时要检查装置的气密性,简述操作的方法是 ;
(5)乙同学通过生成相同体积的CO2来表示反应的速率,需要 仪来记录数据。
查看答案和解析>>
科目:高中化学 来源: 题型:
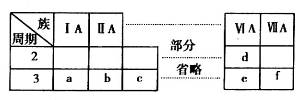 下表是元素周期表的一部分,有关说法不正确的是
下表是元素周期表的一部分,有关说法不正确的是
A.元素e的氧化物对应的水化物均为强酸
B.a、b、d、e四种元素的离子半径: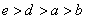
C.b、f两种元素形成的化合物为离子化合物
D.a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
A.氧化性Cr2O72->Fe3+>SO2
B.K2Cr2O7能将Na2SO3氧化成Na2SO4
C.每有1molK2Cr2O7参加反应,转移电子的数目为6NA
D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.2molK2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z为3种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y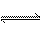 2Z达到平衡时,若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为
2Z达到平衡时,若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为
A.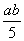 ×100% B.
×100% B.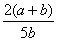 ×100%
×100%
C.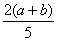 ×100% D.
×100% D.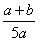 ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1) 在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(2) Y与Z可形成YZ42-,YZ42-的空间构型为 (用文字描述)。
(3) X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有配位键的数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com