
【题目】某学校实验室从化学试剂商店买回的盐酸试剂上的标签如图所示。下列说法正确的是

A.从试剂瓶中取出100 mL该盐酸,在空气中久置,溶液质量将增大
B.1 mol Fe与足量该酸反应产生22.4 L氢气
C.配制250 mL 6 mol · L-1稀盐酸需取该浓盐酸100 mL
D.该溶液溶质的物质的量浓度约为12 mol · L-1
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B.100g46%的甲酸(HCOOH)水溶液中所含的氧原子数目为5NA
C.lmol铁粉高温下与足量水蒸气反应,转移电子数为3NA
D.2molSO2和lmolO2在催化剂作用下充分反应所得分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水只作氧化剂的是
①氟气通入水中 ②水蒸气经过灼热的焦炭 ③钠块投入水中
④铁与水蒸气反应 ⑤氯气通入水中
A. 只有①④ B. 只有①⑤
C. 只有②③ D. 只有②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于如图所示原电池的说法正确的是
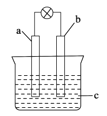
A.当a为Cu,b为含有碳杂质的 Al,c 为稀硫酸时,b 极上观察不到气泡产生
B.当a为石墨,b为 Fe,c为浓硫酸时,不能产生连续的稳定电流
C.当a为Mg,b为 Al,c为NaOH 溶液时,根据现象可推知 Al 的活动性强Mg的
D.当a为石墨,b为 Cu,c为FeCl3 溶液时,a、b之间没有电流通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是制造化肥的重要原料,如图为工业合成氨的流程图。下列有关说法错误的是
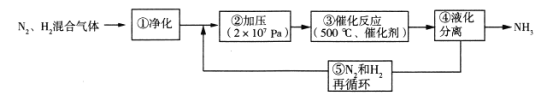
A.工业上制氮气一般用分离液态空气法
B.步骤②、③、④、⑤均有利于提高反应物的平衡转化率
C.步骤①中“净化”N2、H2混合气体可以防止催化剂中毒
D.步骤③中温度选择500℃,主要是考虑催化剂的活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含 Na2CO3·xH2O和 NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 CO2 和 H2O的质量,来确定 Na2CO3··xH2O中 x的数值。
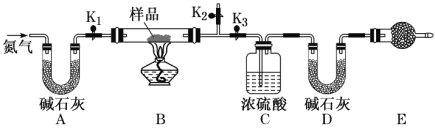
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,检查装置的气密性。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶 C 的质量和盛装碱石灰的 U形管 的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入氮气数分钟,其目的是_________________________。
④关闭活塞K1、K2,打开 K3,点燃酒精灯,加热至不再产生气体。加热时 NaHCO3 发生反应的化学方程式为___________________________________。
⑤打开活塞 K1,缓缓鼓入氮气数分钟,然后拆下装置,再次称量洗气瓶C的质量和 U形管 D的质量。
(2)关于该实验方案,请回答下列问题。
①装置 E的名称是_________,E中盛放的试剂也是碱石灰,其作用是_______________________________。
②若样品质量为 29.3 g,反应后 C、D 装置增加的质量分别为 9 g、4.4 g,则 Na2CO3·xH2O中x为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
A. 体系的体积不再发生变化 B. 生成n mol CO的同时消耗n mol H2O
C. v正(CO)=v逆(H2O) D. 1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)用氧化物的形式表示硅酸盐的组成,钙沸石Ca(Al2Si3O10)·3H2O表示为___。
(2)氢氟酸可刻蚀玻璃,反应的化学方程式为___。
(3)工业上使用漂白粉时常向其中加入稀盐酸,化学方程式为___。
(4)将钠、镁、铝各0.4mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体体积比为___。
(5)向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的质量与所加碱的体积如图所示,若由于碱过量,最终产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积是___mL。
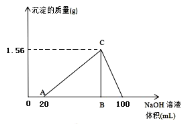
(6)将物质的量之比为2:3:4的N2、O2、CO2混合气体通过一定量Na2O2后,气体体积变为原体积的![]() (同温同压),这时混合气体中N2、O2、CO2物质的量之比为___。
(同温同压),这时混合气体中N2、O2、CO2物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
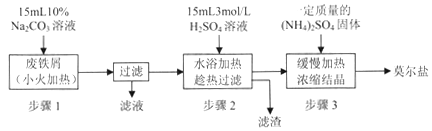
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com