
【题目】2017年世界环境日主题是“人与自然,相联相生” 。下列做法应该提倡的是( )
A. 将工业废液直接排入海洋以减少河道污染 B. 推广使用高效、低毒农药,减轻水体污染
C. 将废旧电池集中深埋,可防止重金属污染 D. 增高燃煤锅炉烟囱,将废气直接排到高空
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁.其工艺流程如图: 
(1)已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3 , 请写出TiOSO4水解成 H2TiO3沉淀的化学方程式:;铁粉的作用有:①除去溶液中的Fe3+ , ② .
(2)沉淀反应的离子方程式是 .
(3)沉淀过程的反应温度为40℃,温度不宜过高的原因除控制沉淀的粒径之外,还有 .
(4)FeC2O4生成时,要在真空环境下进行,原因是 .
(5)过滤2得到的滤液经蒸发浓缩、 , 可得到副产品.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的s能级电子总数与p能级电子总数相等,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题:
(1)E+离子的基态核外电子排布
(2)B、C、D中第一电离能由大到小的顺序为(填元素符号)
(3)A和B、C两元素形成的两种共价化合物发生反应,生成BA4+离子,该离子的中心原子的杂化方式为;与BA4+离子互为等电子体的一种分子为(填化学式).
(4)E的硫酸盐溶液中滴加过量的氨水可以生成配合物[E(NH3)4]SO4 , 1mol配合物中含有的σ键的数目为 .
(5)E和C(空心小球为C,实心小球为E)形成的一种离子化合物的晶体结构如图所示,则离子化合物的化学式为 . 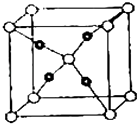
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一份CaCO3粉末放入500mL的盐酸中,恰好完全反应,在标准状况下收集到的CO2 气体体积为22.4L,求
(1)CaCO3的质量.
(2)盐酸物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 二氧化硅溶于水显酸性B. 二氧化硅是酸性氧化物,它不溶于任何酸
C. 二氧化硅和硅都是半导体材料D. 工业上以二氧化硅为原料生产硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸盐材料的说法错误的是
A.生活中常见的硅酸盐材料有玻璃、水泥、陶瓷
B.生产陶瓷的主要原料是黏土
C.普通玻璃的主要成份只有SiO2
D.硅酸盐水泥以石灰石和黏土为主要原料生产
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 镁合金密度虽小,但硬度和强度较大
B. 硅酸钠的水溶液俗称“水玻璃”,是一种建筑行业常用的黏合剂
C. 海水中含量最高的非金属元素是氯元素
D. 根据纤维在火焰上燃烧产生的气味,确定该纤维是否为蛋白质纤维。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算),现提供的试剂有:a.甲酸钠,b.5molL﹣1硝酸,c.5molL﹣1盐酸,d.5molL﹣1硫酸,e.3%H2O2溶液,f.澄清石灰水.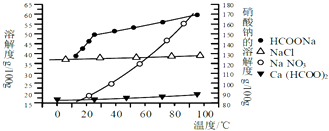
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
请补充完整由碳酸钙制备甲酸钙的实验步骤
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2. .
步骤3. .
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经、、洗涤干燥得甲酸钙晶体.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com