
下列晶体性质的比较中不正确的是( )
A.熔点:金刚石>碳化硅>晶体硅
B.沸点:NH3>PH3
C.硬度:白磷>冰>二氧化硅
D.熔点:SiI4>SiBr4>SiCl4
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A.离子键没有方向性和饱和性,共价键有方向性和饱和性
B.配位键在形成时,由成键双方各提供一个电子形成共用电子对
C.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
D.金属键中的“自由电子”为金属阳离子共用
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层。如图所示的等径圆球排列中,A属于______________层,配位数是__________;B属于________层,配位数是________。
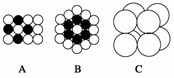
(2)将非密置层一层一层地在三维空间里堆积,得到如图C所示的一种金属晶体的晶胞,它被称为简单立方堆积。在这种晶体中,金属原子的配位数是____________。
(3)有资料表明,只有钋的晶体中的原子具有图C所示的堆积方式。钋位于元素周期表的
________周期、________族,元素符号是________,价电子层的电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.含有非极性共价键的化合物分子一定是非极性分子
B.原子晶体中只存在非极性共价键
C.冰主要是水分子通过氢键作用而形成的分子晶体
D.若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子的空间构型是正四面体形的是( )
①CH4 ②NH3 ③CF4 ④SiH4 ⑤C2H4 ⑥CO2
A.①②③ B.①③④
C.②④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关苯分子结构的说法,错误的是( )
A.苯分子中每个碳原子的原子轨道都发生sp2杂化,形成夹角为120°的三个sp2杂化轨道
B.每个碳原子的一个sp2杂化轨道采用“肩并肩”的方式重叠,形成一个大π键
C.苯分子中存在6个C—C σ键和6个C—H σ键
D.乙烷、乙烯、乙炔分子中,碳原子轨道杂化方式和苯相同的只有乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于离子键的特征的叙述中,正确的是( )
A.一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性
B.因为离子键无方向性,故阴、阳离子的排列是没有规律的,随意的
C.因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl-
D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com