
 .
.
分析 A、D元素基态原子中成对电子数是未成对电子数的3倍,如果成对电子数为6,则未成对电子对为:2,核外电子排布为:1s22s22p4,是氧元素;如果成对电子对是12,不符合;如果成对电子对是18,则未成对电子对为6,则是24号铬,所以A是氧、D是铬;B的基态原子核外只有7个原子轨道填充了电子,B、C元素基态原子的3p能级上均有1个未成对电子,所以B是铝,C是氯元素;E元素排在周期表的15列是砷,由此分析解答.
解答 解:(1)B元素是13号铝,基态原子核外电子有 13种运动状态,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为3,故答案为:13;M;9;3;
(2)氯、砷两元素可以形成化合物AsCl3,As是sp3杂化,所以化合物的VSEPR模型为四面体形,是极性分子,故答案为:四面体形;极性;
(3)铬基态原子的外围电子排布图为: ,故答案为:
,故答案为: ;
;
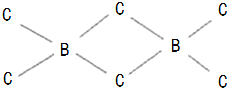
(4)C原子最外层有4个电子,只能与B原子各提供1个电子形成一个共价键,使自己达到8电子稳定结构,而B原子最外层有3个电子,可分别与3个C原子形成共价键,因而C原子与2个B原子形成的化学键中,必有1个是配位键,由于电子对由C原子提供,这样C原子最外层电子数仍为8,B原子最外层也成为8电子结构,如图所示: ,故答案为:
,故答案为: .
.
点评 本题考查了物质的结构中的分子极性、原子的杂化、化学键、配位数的判断等知识,难度一般,注意配位键结构式中箭头的方向.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3 | D. | 0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、IO3?、SO42-、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、SO32-、S2- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在偏铝酸钠溶液中滴入少量的碳酸氢钠溶液HCO3-+AlO2-+H2O=Al(OH)3↓+CO2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+离子刚好完全沉淀2Al3++6OH-+3Ba2++3SO42-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在碳酸氢镁溶液中逐滴加入澄清石灰水至过量Ca2++Mg2++2HCO3-+2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| D. | 氢氧化铁固体溶于氢碘酸 Fe(OH)3+3H+=Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 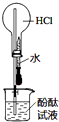 如图实验可观察到红色喷泉 | |
| B. | 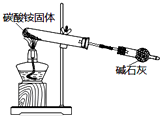 如图实验可制取少量氨气 | |
| C. | 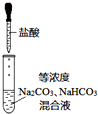 如图实验中逐滴滴加稀盐酸时,试管中立即产生大量气泡 | |
| D. | 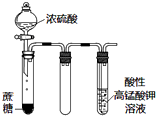 如图实验中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
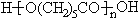 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: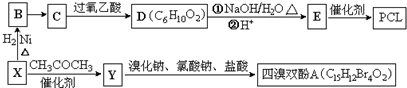
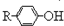 $\stackrel{溴化钠、氯酸钠、盐酸}{→}$
$\stackrel{溴化钠、氯酸钠、盐酸}{→}$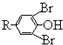
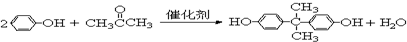 .
.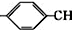 =CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3
=CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3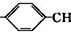 =CHCOOR+2H2O
=CHCOOR+2H2O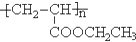 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: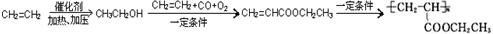 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com