
分析 (1)磷酸钠为盐,属于强电解质,完全电离;
(2)氯气与水反应生成氯化氢和次氯酸;
(3)工业上用电解饱和食盐水法制取氯气,电解饱和食盐水生成氯气、氢气和氢氧化钠.
解答 解:(1)磷酸钠为盐,属于强电解质,完全电离,电离方程式:Na3PO4=3Na++PO43-,故答案为:Na3PO4=3Na++PO43-;
(2)氯气与水反应生成氯化氢和次氯酸,化学方程式:Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO;
(3)电解饱和食盐水生成氯气、氢气和氢氧化钠,化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
点评 本题考查了化学方程式的书写、电解质电离方程式的书写,明确反应实质是解题关键,注意电解质的强弱及电离方式,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色 | |
| C. | 图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大 | |
| D. | 图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝合金的密度小,硬度大,可用作建筑材料 | |
| B. | 铜、铝、钠可以分别用热还原法、热分解法和电解冶炼 | |
| C. | 电解从海水中得到的氯化镁溶液可获得金属镁 | |
| D. | 工业上用铝热反应来冶炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,所以不能用氯气对自来水进行消毒 | |
| B. | 液氯是纯净物,而氯水是混合物 | |
| C. | 碘化钾水溶液能使淀粉变蓝 | |
| D. | 在一个反应中,氧化剂和还原剂不可能是同一物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molH2(g)释放483.6kJ的能量 | |
| B. | 每生成1molH2O(g)释放483.6kJ的能量 | |
| C. | 方程式中H2(g)计量数改变△H值不变 | |
| D. | 同条件下2molH2O(g)完全分解吸收的能量为483.6kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
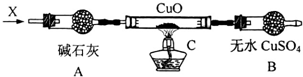 铜是常见的变价金属.为了比较正一价铜和正二价铜的稳定性,并研究氧化铜的氧化性,某化学小组的同学进行了以下实验.
铜是常见的变价金属.为了比较正一价铜和正二价铜的稳定性,并研究氧化铜的氧化性,某化学小组的同学进行了以下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com