
【题目】含有![]() 的
的![]() 浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米
浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米![]() 。
。

(1)![]() 基态核外电子排布式为_______。
基态核外电子排布式为_______。
(2)与![]() 互为等电子体的一种分子为___________(填化学式)。
互为等电子体的一种分子为___________(填化学式)。
(3)醛基中碳原子的轨道杂化类型是________;1![]() 乙醛分子中含有的
乙醛分子中含有的![]() 键的数目为__________。
键的数目为__________。
(4)含有![]() 的
的![]() 悬浊液与乙醛反应的化学方程式为_____________。
悬浊液与乙醛反应的化学方程式为_____________。
(5)![]() 在稀硫酸中生成
在稀硫酸中生成![]() 和
和![]() 。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为__________。
。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为__________。
【答案】![]() (或
(或![]() )
)![]()
![]() 6NA (或
6NA (或![]() 个)
个)![]()
![]()
![]() 12
12
【解析】
(1)Cu为29号,Cu+核外还有28个电子,按照核外电子排布规律,应为[Ar]3d10或1s22s22p63s23p63d10,故答案为:[Ar]3d10或1s22s22p63s23p63d10;
(2)OH-含有10个电子,根据等电子体的含义,可知10电子的双原子分子为HF,故答案为:HF;
(3)—CHO中含碳氧双键,为平面结构,故中心原子碳原子采取sp2杂化。 1 mol CH3CHO中含有5 mol单键、1 mol双键,故含σ键为5 mol+1 mol=6 mol,故答案为:sp2;6 NA;
(4)Cu(OH)2被CH3CHO还原为Cu2O,CH3CHO被氧化为CH3COOH,再与NaOH反应生成CH3COONa,故反应为2Cu(OH)2+CH3CHO+NaOH![]() CH3COONa+Cu2O↓+3H2O,故答案为:2Cu(OH)2+CH3CHO+NaOH
CH3COONa+Cu2O↓+3H2O,故答案为:2Cu(OH)2+CH3CHO+NaOH![]() CH3COONa+Cu2O↓+3H2O;
CH3COONa+Cu2O↓+3H2O;
(5)铜晶胞为面心立方晶胞,故每个铜原子周围距离最近的铜原子为4×3=12,故答案为:12;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数,下列说法正确的是( )
表示阿伏加德罗常数,下列说法正确的是( )
A. 2.0gH218O 与D2O的混合物中所含的中子数为NA
B. ![]() 氢气含有
氢气含有![]() 分子数目为
分子数目为![]()
C. ![]() 所含的分子数为
所含的分子数为![]()
D. ![]() 的
的![]() 中含离子数为
中含离子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学反应能量变化相关的叙述不正确的是
A. 化学反应是旧键断裂和新键形成的过程
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO+ Cl
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3+2OH===CaCO3↓+CO32+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
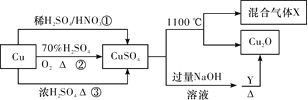
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B. 相对于途径①、③,途径②更好地体现了绿色化学思想
C. 1 mol CuSO4在1100 ℃所得混合气体X中O2为0.75 mol
D. Y可以是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 无色溶液中:Na+、NH4+、Cu2+、SO42-
B. ![]() =1×10-12 的溶液中:K+、Na+、CO32-、NO3-
=1×10-12 的溶液中:K+、Na+、CO32-、NO3-
C. 与铝反应产生大量氢气的溶液:Na+、NH4+、HCO3-、Cl-、
D. 酸性溶液中:Na+、ClO-、I-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂(易被氧化)。实验室利用如图所示装置制取少量焦亚硫 酸钠,并探究 SO2 的性质 (夹持装置已略去)。

请回答下列问题:(实验前已除去装置中的空气)
(1)仪器 a 的名称是_____。
(2)关闭 K2、K3,打开 K1,装置 B 中发生反应的离子方程式为_________,观察到装 置 C 中发生的现象是_____。
(3)装置 D 和 F 的作用是____。
(4)实验前,E 中所用蒸馏水需经煮沸后迅速冷却,目的是_____, 关闭 K1、K3,打开 K2,一段时间后 E 中有 Na2S2O5 晶体析出,装置 E 中发生反应的化学方程式为__________________。
(5)设计实验验证 Na2S2O5 晶体在空气中已被氧化,所需试剂为_____。
(6)在测定某葡萄酒中Na2S2O5 残留量时,取 40.00 mL 葡萄酒样品,加入指示剂,用 0.01000 mol·L1 的碘标准液滴 定,当溶液_________,即为终点。测定实验中,消耗碘标准液 10.00 mL,该样品中Na2S2O5的残留量为_____g·L1(以 SO2 计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com