
分析 金属的腐蚀本质是金属原子失去电子被氧化的过程;
由于与金属接触的介质不同,发生腐蚀的化学原理也不同,一般可分为化学腐蚀和电化学腐蚀,化学腐蚀是指金属单质直接与氧化性物质反应而被氧化;
电化学腐蚀是形成原电池,被腐蚀金属做负极,腐蚀速率更快,更普遍.
解答 解:金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程,成为金属的腐蚀;
金属单质直接与氧化性物质反应而被氧化发生的腐蚀为化学腐蚀;
形成原电池,被腐蚀金属做负极,发生氧化反应被腐蚀,为电化学腐蚀;
电化学腐蚀更普遍,腐蚀速率更快;
故答案:金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程;化学腐蚀;电化学腐蚀;电化学腐蚀.
点评 本题考查了化学腐蚀的概念及分类,侧重考查学生对基础知识掌握的熟练程度,题目难度不大,注意对相关知识的记忆.


科目:高中化学 来源: 题型:解答题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
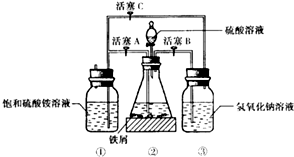
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的最外层电子数:X>Y>Z | B. | 单质沸点:Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
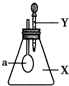 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )| X | Y | |
| A | NH3 | H2O |
| B | SO2 | NaOH溶液 |
| C | CO2 | 6mol•L-1 H2SO4溶液 |
| D | HCl | 6mol•L-1 Na2SO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 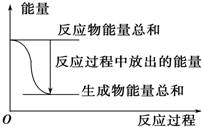 反应过程中能量关系可用如图表示 | |
| B. | △H的值与反应方程式的计量系数有关 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )| A. | -1 638 kJ/mol | B. | +1 638 kJ/mol | C. | -126 kJ/mol | D. | +126 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | (1) | (2) | ||||||
| 三 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 四 | (10) | (11) | (12) |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com