
 苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金.Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成SO4深蓝色溶液.
苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金.Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成SO4深蓝色溶液.分析 (1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;
(2)单键为σ键,双键含有1个σ键,Ni(CO)4分子中含有8个σ键;
(3)计算S原子的价电子对数进行判断;具有相同原子数和价电子数的微粒互称为等电子体;
(4)由于NH3分子之间存在氢键,所以NH3的沸点高于PH3;
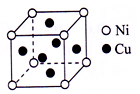
(5)根据均摊法计算晶胞中Ni、Cu原子数目.
解答 解:(1)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1 或3d104s1,
故答案为:ls22s22p63s23p63d104s1 或3d104s1;
(2)分子中存在4个Ni-C键,为σ键,含有4个C=O键,则含有4个σ键,共8mol或8×6.02×1023,故答案为:8mol或8×6.02×1023;
(3)SO42-的价电子对数=$\frac{6+2}{2}$=4,形成四条杂化轨道,S原子的杂化方式为sp3,形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;具有相同原子数和价电子数的微粒互称为等电子体,所以与SO42-互为等电子体的微粒有CCl4等;
故答案为:正四面体;CCl4;
(4)由于NH3分子之间存在氢键,所以NH3的沸点高于PH3,
故答案为:高于;NH3分子间存在氢键;
(5)晶胞中Ni处于顶点,Cu处于面心,则晶胞中Ni原子数目为8×$\frac{1}{8}$=1、Cu原子数目=6×$\frac{1}{2}$=3,故Cu与Ni原子数目之比为3:1,
故答案为:3:1.
点评 本题考查较为综合,为高考常见题型,侧重考查学生的分析能力的考查,涉及核外电子的排布、分子的空间构型、配位键、晶胞的计算等知识点,难度较大,会利用均摊法计算晶胞中含有的离子,注意运用余弦定理计算硫离子和锌离子之间的距离,为难点.


科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu互为同素异形体 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的最外层电子数 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗,这利用了胶体的渗析原理 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装中放入生石灰或硅胶 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 化工厂可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:W>X>Y | |
| B. | W的简单气态氢化物的热稳定性比Y的弱 | |
| C. | Z分别与Q、X形成的化合物中化学键类型相同 | |
| D. | X的最高价氧化物对应水化物的碱性在同周期中最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g乙烯气体中的氢原子数约为2×6.02×1023 | |
| B. | 标准状况下,2.24 L H2O含有的共价键数约为0.2×6.02×1023 | |
| C. | 1 mol N2与3 mol H2反应生成的NH3分子数约为2×6.02×1023 | |
| D. | 0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数约为0.05×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com