
分析 影响化学反应速率的主要因素为物质本身性质,而常见影响化学反应速率的外界因素有浓度、温度、催化剂以及固体表面积大小等,结合题给信息解答该题.
解答 解:(1)镁条燃烧发出耀眼的白光,氢气和氯气在光照条件下反应,故答案为:光照;
(2)MnO2为KClO3分解的催化剂,加入催化剂,可增大反应速率,故答案为:催化剂;
(3)冬天温度较低,温度越低,反应速率越小,故答案为:温度;
(4)镁比锌活泼,与盐酸反应较剧烈,为物质的本身性质决定反应速率,故答案为:本身性质.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于基础知识的综合理解和运用的考查,注意把握影响化学反应速率的常见因素和原因,注意相关基础知识的积累,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
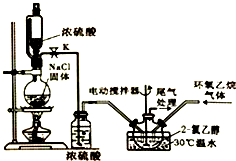 2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.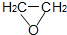 (g)+HCl(g)?ClCH2CH2OH(l)△H<0
(g)+HCl(g)?ClCH2CH2OH(l)△H<0| 化合物名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) |
| 环氧乙烷 | 44 | -112,2 | 10.8 |
| 2-氯乙醇 | 80.5 | -67.5 | 128.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中没有碳碳双键 | |
| B. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| C. | 乙醇能与金属钠反应,乙酸也能与金属钠反应 | |
| D. | 乙烯和苯都能使溴水褪色,褪色的原因相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
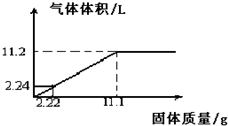
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24Mg32S 晶体中电子总数与中子总数之比为1:1 | |
| B. | CO2和PCl5分子中各原子最外层都满足8 电子结构 | |
| C. | 若aXm+和bYn-两种离子电子层结构相同,则a-b=n-m | |
| D. | 元素周期表中第4 列元素形成的化合物数目最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.1 g | B. | 27.2 g | C. | 30 g | D. | 19.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
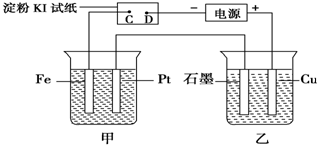
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com