
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省宝鸡市高三教学质量检测(二)理综化学试卷(解析版) 题型:填空题
已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26。
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:

回答下列问题:
(1)B元素原子核外已成对电子数是未成对电子数的____倍。
(2)X、Y、Z的电负性从大到小的顺序为____(用元素符号表示)。
(3)分子式为A2B、A2E的两种物质中 __更稳定(用化学式表示),原因是____。
(4)X的氯化物的熔点比Y的氯化物的熔点____,原因是____。
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为____。等电子体指的是原子总数相同.价电子总数相同的分子.离子或基团,据此定义写出离子SCN—的一种等电子体____。
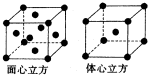
(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为- 20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)5的晶体类型为 。F元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如
图所示。在面心立方晶胞中F原子的配位数为____,体心立方晶胞的密度可表示为____。(F的原子半径为r)

查看答案和解析>>
科目:高中化学 来源:2014届江苏泰州二中高二上学期期中考试化学(选修)试卷(解析版) 题型:填空题
(18分)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)铁元素位于元素周期表的 区;其基态原子的电子排布式为 。
(2)铜原子的价电子排布式为 ,画出配离子[Cu(H2O)4]2+中的配位键____ _______ 。
(3)二氧化碳分子的立体构形为 形,其中C原子的杂化方式为 杂化,二氧化碳分子中含有 个σ键和 个π键。
(4)氨分子属于 分子(填“极性”或“非极性”);氨极易溶于水最主要的原因是氨分子和水分子之间可以形成 。
(5)下列元素的第一电离能最大的是( )
A.Be B.C C. N D.O
(6)下列分子中,所有原子都满足最外层为8电子结构的是 ( )
A.XeF2 B.BeCl2 C.PCl3 D.CHCl3
(7)下列晶体中,熔点最高的是 。
A.金刚石 B.干冰 C.铝 D.氯化钠
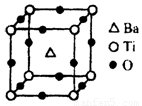
(8)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如上图,它的化学式是 。
查看答案和解析>>
科目:高中化学 来源:湖北省期中题 题型:单选题
| 下列有关表述均正确,且存在因果关系的是 | |||||||||||||||
|
[ ] | |||||||||||||||
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com