
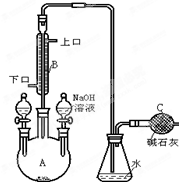
 制备一溴异丙苯的实验装置如图所示,下列操作正确的是( )
制备一溴异丙苯的实验装置如图所示,下列操作正确的是( )| A. | 装在左侧分液漏斗中的药品是苯和液溴 | |
| B. | 右侧分液漏斗中的物质的作用是催化剂 | |
| C. | 可向锥形瓶中加入硝酸酸化的AgNO3溶液,有淡黄色沉淀产生,说明此反应为取代反应 | |
| D. | 可在B与锥形瓶之间连接一个 装置并加入CCl4液体来除去HBr中溴蒸气 装置并加入CCl4液体来除去HBr中溴蒸气 |
分析 A.异丙苯和液溴能反应生成一溴异丙苯;
B.溴能与氢氧化钠反应;
C.反应生成了溴化氢溶于水中电离出溴离子和银离子,加入硝酸银反应生成淡黄色沉淀溴化银;
D.应用洗气装置.
解答 解:A.装在左侧分液漏斗中的药品是反应物异丙苯和液溴,故A错误;
B.溴能与氢氧化钠反应,一溴异丙苯不反应,氢氧化钠的作用是除去一溴异丙苯中的溴,故B错误;
C.反应生成了溴化氢溶于水中电离出溴离子和银离子,加入硝酸银反应生成淡黄色沉淀溴化银,说明溴单质和苯的反应是发生了取代反应,故C正确;
D. 不能洗气,应用洗气装置,故D错误.
不能洗气,应用洗气装置,故D错误.
故选C.
点评 本题主要考查了有机物的性质实验,掌握反应的原理、各物质的性质以及操作的方法是解题的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).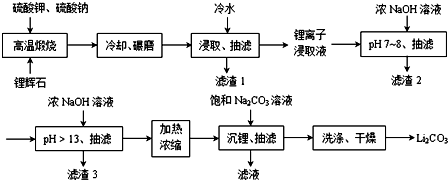
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10 | 20 | 50 | 80 |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烷(乙烯):通过盛有溴水的洗气瓶 | |
| B. | KNO3(NaCl):溶解,蒸发结晶,趁热过滤 | |
| C. | 溴苯(溴):加入氢氧化钠溶液,然后分液 | |
| D. | 乙醇(水):加入浓硫酸,然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未加盐酸时:c(OH-)>c(Na+)=c(NH3•H2O) | B. | 加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-) | ||
| C. | 加入盐酸至溶液pH=7时:c(Cl-)=c(Na+) | D. | 加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com