
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||

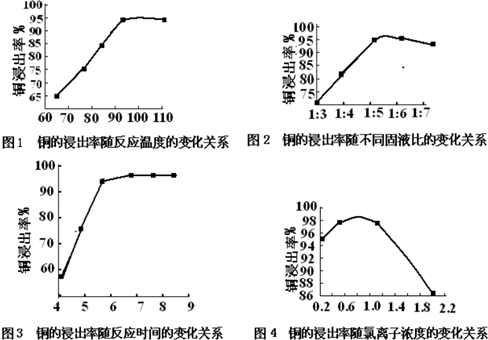
| 选项 | 反应温度/℃ | 固液比 | c(Cl-)/mol?L-1 | 反应时间/h |
| a | 100 | 1:5.5 | 0.7 | 7 |
| b | 95 | 1:5 | 0.8 | 6 |
| c | 110 | 1:6 | 0.9 | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定条件下能分解为SO2和O2 |
| B、是硫酸的酸酐 |
| C、其中硫元素已不能再被氧化 |
| D、取8g SO3溶于92g水中得8%溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、反应①是复分解反应 |
| B、反应②是置换反应 |
| C、反应①中TiO2是氧化剂 |
| D、反应②中金属镁是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
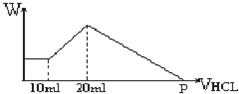 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
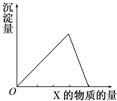 把X溶液(或气体)慢慢加入(或通入)到一定量的Y溶液中,产生的沉淀量与加入(或通入)的X物质的量的关系如图所示,符合图中曲线的是( )
把X溶液(或气体)慢慢加入(或通入)到一定量的Y溶液中,产生的沉淀量与加入(或通入)的X物质的量的关系如图所示,符合图中曲线的是( )| A、X为CO2,Y为Ca(OH)2 |
| B、X为NH3?H2O,Y为AlCl3 |
| C、X为NaOH,Y为AlCl3 |
| D、X为HCl,Y为Na[Al(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:
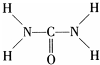 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com