
【题目】三容器内分别装有相同压强下的NO、NO2、O2,设三容器容积依次为V1、V2、V3,若将三气体混合于一个容积为V1 + V2 +V3的容器中后,倒立于水槽中,最终容器内充满水。则V1、V2、V3之比不可能是( )
A.3∶7∶4B.5∶7∶6C.7∶3∶6D.1∶1∶1
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】关于NA下列说法正确的是
A. 常温常压下,17g羟基(—18OH)所含中子数为9NA
B. 0.1mol NH3溶于水形成的溶液中,微粒NH3·H2O和微粒NH4+的数目之和为0.1NA
C. 常温下电解饱和食盐水,当溶液pH值由7变为12时,电路中转移的电子数为0.01NA
D. 标准状况下,足量的甲烷与22.4LCl2(假设氯气完全反应)在光照条件下发生取代反应,形成C-Cl键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1 mol/L HCl溶液、1滴1 mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如下图所示。
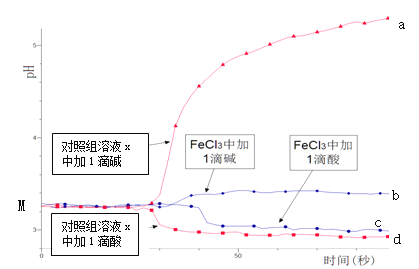
下列说法不正确的是
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液x的组成可能是0.003 mol/L KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)![]() x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
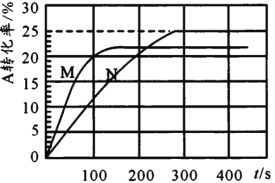
A.x可能为4
B.M为容器甲
C.容器乙达平衡时B的转化率为25%
D.M的平衡常数大于N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx(主要成分为NO、NO2的混合物),对烟气进行脱硫、脱硝有多种方法。
(1)碱液吸收法:采用石灰乳脱除SO2.脱除后的主要产物是_____。
(2)液相氧化法:采用 NaClO溶液进行脱除。
①NaClO水解的离子方程式是_____。
②NaClO溶液吸收NO的主要过程如下
i.NO(aq)+HClO(aq)NO2(aq)+HCl(aq) △H1
ii.3NO2(aq)+H2O(1)2HNO3(aq)+NO(aq) △H2
NO(aq)转化为HNO3(aq)的热化学方程式是_____。
③研究pH对NO脱除率的影响。调节 NaClO溶液的初始pH,NO的脱除率如表:
初始pH | 3.5 | 4.5 | 5.5 | 6.5 | 7.5 |
NO脱除率 | 91% | 88% | 83% | 65% | 51% |
pH影响NO脱除率的原因是_____。
(3)研究发现,在液相氧化法中,一定量的SO2能提高NOx的脱除率。当pH=5.5时,SO2对有效氯含量、NOx脱除率的影响如图所示。
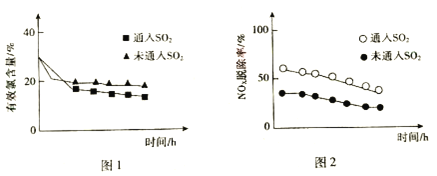
①据图1,通入SO2后有效氯含量降低。SO2和HClO反应的离子方程式是_____。
②针对图2中NOx脱除率提高的原因,研究者提出了几种可能发生的反应:
A.SO2+2NO+H2O═N2O+H2SO4
B.2SO2+2NO+2H2O═N2+2H2SO4
C.4SO2+2NO2+4H2O═N2+4H2SO4
用同位素示踪法确认发生的反应:把15NO2和NO按一定比例混合,通入SO2的水溶液中,检测气体产物。
a.气体产物中主要含有15NO2、N2O,则发生的主要反应是_____(填序号)。
b.同时检测到气体产物中还有15N N,产生15N N的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下0.1 mol/L的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列关系一定正确的是( )
A. c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B. c(Na+)=0.1 mol/L≥c(B2-)
C. HB-的水解方程式为HB-+H2O![]() B2-+H3O+
B2-+H3O+
D. 在该盐的溶液中,离子浓度大小顺序为c(Na+)>c(HB-)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g)![]() xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(Lmin),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(Lmin),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com