
| A. | 加热NaHSO4至熔化NaHSO4═Na++H++SO42- | |
| B. | 把CaO放入水中CaO═Ca2++O2- | |
| C. | HClO═H++ClO- | |
| D. | H2S?H++HS-;HS-?H++S2- |
分析 A.亚硫酸氢钠熔融状态电离生成钠离子和硫酸氢根离子;
B.氧化钙与水反应生成氢氧化钙;
C.次氯酸为弱酸,部分电离;
D.硫化氢为多元弱酸分步电离.
解答 解:A.加热NaHSO4至熔化,电离方程式:NaHSO4═Na++HSO4-,故A错误;
B.氧化钙与水反应生成氢氧化钙,离子方程式:CaO+H2O═Ca2++2OH-,故B错误;
C.次氯酸为弱酸,部分电离,离子方程式:HClO?H++ClO-,故B错误;
D.硫化氢为多元弱酸分步电离,电离方程式:H2S?H++HS-;HS-?H++S2-,故D正确;
故选:D.
点评 本题考查了电解质电离方程式书写,明确电解质强弱及电离方式是解题关键,注意多元弱酸分步电离,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 必为第1层 | B. | 只能是第2层 | C. | 只能是第3层 | D. | 可以是任意层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LNH3中含有的氢原子数为3NA | |
| B. | 标准状况下,足量Na2O2和11.2LCO2反应,转移电子数目为NA | |
| C. | 常温常压下,16g CH4中所含中子数为10NA | |
| D. | 常温常压下,2.8g乙烯中含有碳氢键的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③⑤ | C. | ②③④⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
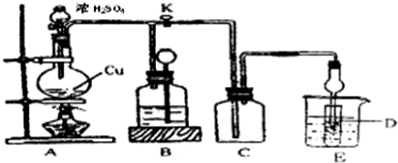
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
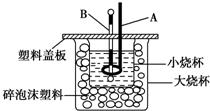 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.回答有关中和反应的问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com