
| A. | 1.8 g D2O含有NA个中子 | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 5.35 g NH4Cl固体中含有N-H键的个数为0.4NA | |
| D. | 常温下将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA |
分析 A、n=$\frac{m}{M}$ 计算物质的量,结合质子数+中子数=质量数计算中子数;
B、标况下,己烷为液态;
C、根据n=$\frac{m}{M}$ 计算出氯化铵的物质的量,氯化铵中含有4个氮氢键;
D、常温下铁在浓硝酸中发生钝化.
解答 解:A、1.8gD2O的物质的量为$\frac{1.8g}{20g/mol}$=0.09mol,而1mol重水中含10个中子,故0.09mol重水中含0.9NA个,故A错误;
B、标况下,己烷为液态,故B错误;
C、5.35g氯化铵的物质的量为$\frac{5.35g}{53.5g/mol}$=0.1mol,0.1mol氯化铵中含有0.4mol氮氢键,含有的N-H键个数为0.4NA,故C正确;
D、常温下铁在浓硝酸中发生钝化,不能继续反应,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,气体摩尔体积条件分析应用,注意常温下铁在浓硝酸中发生钝化,题目难度中等.


科目:高中化学 来源: 题型:解答题

 +R3
+R3 $\stackrel{C_{2}H_{5}ONa}{→}$
$\stackrel{C_{2}H_{5}ONa}{→}$ +R2OH
+R2OH .
. .
.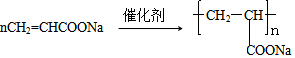 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
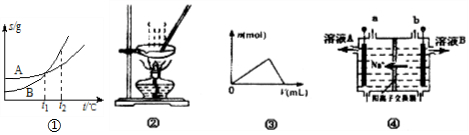
| A. | 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| B. | 用图②所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 图③可以表示向一定量的明矾溶液中逐滴摘加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(N2)=2.25 mol/L | B. | c(NH3)=1.9 mol/L | C. | c(H2)=0.3 mol/L | D. | c(N2)=1.3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干电池中Zn为正极,碳为负极 | |
| B. | 干电池可以实现化学能向电能的转化和电能向化学能的转化 | |
| C. | 干电池长时间连续使用时内装糊状物可能流出腐蚀电器 | |
| D. | 干电池工作时,电子由碳极经外电路流向Zn极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA | |
| B. | 12 g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 0.1molFe与稀硝酸恰好反应完后,溶液中NO3-的数目为0.3NA | |
| D. | l L pH=l的硫酸溶液中含有的H+数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、并能使红色湿润石蕊试纸变蓝,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.下图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、并能使红色湿润石蕊试纸变蓝,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.下图中均含D或F元素的物质均会有图示转化关系: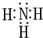 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷是正四面体结构,性质活泼,常温下能与强酸、强碱发生剧烈反应 | |
| B. | 乙烯是通过石油裂解得到的,属于不饱和烃 | |
| C. | 苯与氢气、液溴、浓硝酸的反应类型相同 | |
| D. | 乙酸又名醋酸,其官能团是醚基,可以与乙醇发生反应生成乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com