
【题目】金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 ,
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)下图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为 ,

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
【答案】(1)bd;
(2)Cu2S;4;H2;
(3)a;2H++NO3-+e-→NO2+H2O;
(4)做电解质溶液(或导电)。
【解析】
试题分析:(1)电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得;
(2)失电子化合价升高的反应物是还原剂,根据得失电子相等计算失去电子的物质的量,硫酸铜溶液呈酸性,镁和酸反应生成氢气;
(3)电解精炼银时,粗银作阳极,若b极有少量红棕色气体生成,则b电极上硝酸根离子得电子生成二氧化氮;
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,该装置构成原电池,食盐水作电解质溶液,促进溶液的导电性.
解:(1)活泼金属采用电解法冶炼,钠、铝都是活泼金属,采用电解熔融态NaCl、Al2O3的方法冶炼,故选bd;
(2)在该反应中,Cu元素化合价由+1升高到+2,S元素由﹣2升高到+6,所以Cu2S做还原剂;
氧化还原反应中得失电子数相等,所以当有1molO2参与反应时失去4mol电子,则还原剂所失电子的物质的量为4mol;
硫酸铜是强酸弱碱盐,其溶液呈酸性,镁和酸反应生成氢气,
故答案为:Cu2S;4;氢气;
(3)电解精炼时,粗银做阳极,所以粗银是a极;
b电极是阴极,发生还原反应,生成了红棕色气体是NO2,电极反应:NO3﹣+e﹣+2H+=NO2↑+H2O,
故答案为:a;NO3﹣+e﹣+2H+=NO2↑+H2O;
(4)该装置构成原电池,氯化钠溶液作电解质溶液,促进溶液的导电能力,故答案为:作电解质溶液,形成原电池.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】表示下列变化的化学用语正确的是
A. 氨水显碱性:NH3·H2O![]() NH4++OH-
NH4++OH-
B. 醋酸溶液显酸性:CH3COOH=CH3COO-+H+
C. NaHCO3溶液显碱性:HCO3-+H2O![]() CO32-+OH-
CO32-+OH-
D. 铁在潮湿空气中被腐蚀的负极反应:Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
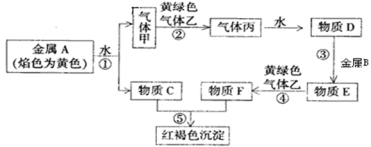
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如图反应。(图中有些反应的产物和反应条件没有标出)
请回答下列问题:
(1)丙的化学式为____。
(2)A的一种氧化物为淡黄色固体,该物质的电子式为___。
(3)写出气体乙与C溶液反应的离子方程式:____。
(4)若将C溶液与E溶液混合,则可以观察到的现象是:____。
(5)配制F溶液时,要将F固体先溶于较浓的盐酸中,再加水稀释,其目的是___(用简单文字和离子方程式说明)。
(6)设计一种检验物质E溶液中金属阳离子实验方案:____(写出实验步骤,现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NaOH的摩尔质量为40g
B.22.4 L气体所含分子数一定大于11.2 L气体所含的分子数
C.标准状况下,1 mol任何物质的体积都约为22.4 L
D.标准状况下,1 mol 由O2和N2按任意比组成的混合气体的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O5是常用的防腐剂和漂白剂。可利用烟道气中的SO2生产Na2S2O5,其流程如下:
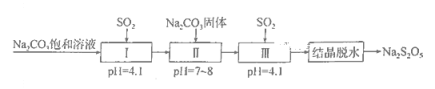
下列说法正确的是( )
A. 上述流程中的Na2CO3饱和溶液和Na2CO3固体不可互换
B. Na2S2O5作防腐剂和SO2作漂白剂时,均表现还原性
C. 上述制备过程所涉及的物质中只有一种酸性氧化物
D. 实验室模拟“结晶脱水”时用到的仪器只有蒸发皿、玻璃棒、烧杯、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:
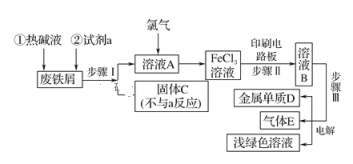
(1)热碱液的作用_____________;
(2)试剂a应选用________(填写名称);
(3)步骤Ⅰ用到的主要玻璃仪器有漏斗、_____(填写仪器名称);
(4)写出步骤Ⅱ中主要反应的化学方程式______;
(5)实验室制取气体E的离子方程式是____,欲对气体E进行干燥和吸收,需选用下列装置中的____(填写序号);
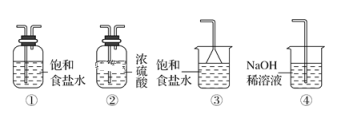
(6)如何用化学方法检验气体E?_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸H2C2O4(一种二元弱酸)能使酸性高锰酸钾溶液褪色,其反应可以表示如下:2KMnO4+3H2SO4+5H2C2O4=K2SO4+2MnSO4+10X↑+8H2O
(1)已知相同条件下X气体对H2的相对密度为22,则X的化学式为__;
(2)该反应中的氧化剂是__,还原剂是__(填化学式)。
(3)若该反应中生成的还原产物的物质的量为0.2mol,则生成的X气体在标况下的体积为__。
(4)写出该反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键线式是表达有机化合物结构的一种方式,如H2N-CH2-CH2-OH用键线式可以表达为![]()
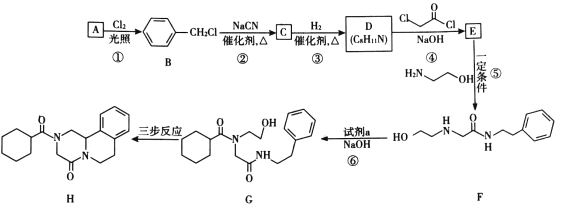
吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
已知i.R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii.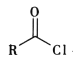 +R′-NH-R″+NaOH
+R′-NH-R″+NaOH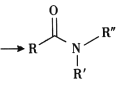 +NaCl+H2O
+NaCl+H2O
(1)A属于芳香烃,其名称是____。
(2)②的反应类型是____。
(3)B的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为____。
(4)③中1 mol C理论上需要消耗____mol H2生成D。
(5)④的化学方程式是____。
(6)F中含氧官能团是 和____。
和____。
(7)试剂a的结构简式是____。
(8)G→H分为三步反应,J中含有3个六元环,写出I、J的结构简式______、______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究.为测定黄铜矿中硫元素的质量分数,将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品.
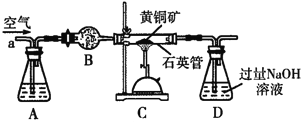
(1)锥形瓶A内所盛试剂是__________;装置B的作用是__________;锥形瓶D内发生反应的离子方程式为__________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:
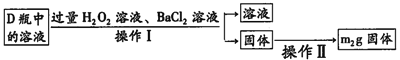
如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为__________;操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法__________;该黄铜矿中硫元素的质量分数为__________(用含m1、m2的代数式表示).
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是__________
A.KSCN溶液、氯水B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+.设计实验方案验证泡铜中是否含有Cu2O__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com