
����Ŀ���л����(C13H18O2)��һ�����ϣ���ϳ�·����ͼ��ʾ�����м���Է�������ͨ���������Ϊ88�����ĺ˴Ź���������ʾֻ������壻�����պ��㴼
��1������ϵͳ��������A����������
��2��C������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽ��
��3�����к���������CH3 �� �ڴ�������������1molD��2molH2��Ӧ���������ң�D���Է���������Ӧ����D�Ľṹ��ʽΪ��
��4�������ҷ�Ӧ�Ļ�ѧ����ʽΪ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У���˵��SO2��������������ǣ� ��
A. SO2 + H2O = H2SO3B. SO2 + 2NaOH = Na2SO3 + H2O
C. 2SO2 + O2 = 2SO3D. SO2 + CaO = CaSO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A. ����ͼװ�õ�⾫��þ
����ͼװ�õ�⾫��þ
B. ����ͼװ����֤�Թ�����˿�������ⸯʴ
����ͼװ����֤�Թ�����˿�������ⸯʴ
C. ��ͼװ����Mg��������Al������
��ͼװ����Mg��������Al������
D.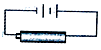 ����ͼװ�öԶ��ε�ؽ��г��
����ͼװ�öԶ��ε�ؽ��г��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����Ʒ���п���ʴ���������ʵ��ӳ���ʹ��������
��1������ʴ����ǰ�������г��������������⣮�ֽ�һ����������������������У���ȥ����Ļ�ѧ��Ӧ�����ӷ���ʽΪ�� ��
��2��������ͼװ�ã�����ģ�����ĵ绯ѧ������ ����XΪ̼����Ϊ���������ĸ�ʴ������KӦ��������
����XΪп������K����M�����õ绯ѧ��������Ϊ ��
��3��ͼ����XΪ��ͭ�������к�ˮ�滻Ϊ����ͭ��Һ������K����N����һ��ʱ���������������3.2gʱ��ת�Ƶĵ�����ΪNA �� ���������ͭ����Ч��ֹ������ʴ�������������δ����ͭ����Ʋ����𣬶�ͭ���ȶ�п���������ױ���ʴ�����Ҫ˵��ԭ�� �� 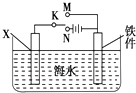
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������գ�
��1����֪H+��aq��+OH����aq���TH2O��l����H=��57.3kJmol��1 �� �������ݵ�����������ʵ���Ũ�ȵ�NaOH��Һ�зֱ������ᡢŨ���ᡢϡ������ǡ����ȫ��Ӧ���������������зų��������ֱ��ΪQ1kJ��Q2kJ��Q3kJ�������ߵ���С�����ϵ������Q1��Q2��Q3��ʾ����
��2����ͼ��ʾAΪ��ĭ���ϰ壬����������С�ף��ֱ�����¶ȼƺͻ��β��������������С�ײ��ܿ��ù�����Ŀ������ ��ʵ���в��Ӹ���ĭ���ϰ壬����õ��к�����ֵ����ƫ��ƫС����Ӱ�죩 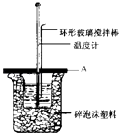
��3��ʵ������50mL 0.50molL��1���ᡢ50mL 0.55molL��1NaOH��Һ������ͼװ�ã����вⶨ�к��ȵ�ʵ�飮�������������������Һ���ܶȶ���1g/cm3 �� ��֪�кͺ�������Һ�ı�����c=4.18J/��g�棩��Ϊ�˼����к��ȣ�ʵ��ʱ��������������У�����ţ� ��
A.��Ӧǰ������¶�
B.��Ӧǰ���������
C.��Ӧǰ����������Һ���¶�
D.��Ӧǰ����������Һ������
E.��Ӧ������Һ������¶�
F.��Ӧ������Һ������
��4��ijѧ��ʵ���¼�������£�
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | ����������Һ | �����Һ | |
1 | 20.0 | 20.1 | 23.4 |
2 | 20.2 | 20.4 | 23.6 |
3 | 20.5 | 20.6 | 23.8 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к��ȡ�HΪ �� ��������λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����½ṹ��ʽ��ʾһ���л���Ľṹ�����������ʵ���������ȷ����(����)
A.�������ԣ����봿����Һ��Ӧ
B.����ˮ�⣬��ˮ�����ֻ��һ��
C.1 mol���л����������7 mol NaOH��Ӧ
D.���л����ܷ���ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������X(C7H8O)����һ�л�������Y�������·�Ӧ���ɻ�����Z(C11H14O2)��![]()
��1��X�����л�����֮һ����֪X������FeCl3��Һ������ɫ��Ӧ����X��(����ĸ)��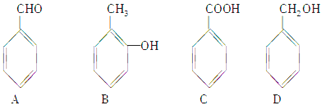
��2��Y�ķ���ʽ�� �� ���ܵĽṹ��ʽ������
��3��Y�ж���ͬ���칹�壬����һ��ͬ���칹��E����������Ӧ������ᆳ�ữ�ɵõ�F(C4H8O3)��F�ɷ������·�Ӧ��![]()
�÷�Ӧ�������� �� E�Ľṹ��ʽ����
��4����Y��E������ͬ��̼������Z�Ľṹ��ʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ9.7g ��Cu��Zn�Ͻ���������ϡHNO3��Ӧ����ԭ����ֻ��NO���壬������ڱ�״����Ϊ2.24L������Һϡ��Ϊ1L�������Һ��pH=1����ʱ��Һ��NO3����Ũ��Ϊ��������
A.0.3 molL��1
B.0.4 molL��1
C.0.5 molL��1
D.0.6 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2Na2CO33H2O2��һ�����͵���ϵƯ����ijʵ����ȤС�����������ʵ�飮
��ʵ���Ʊ�
ʵ��ԭ����2Na2CO3+3H2O2�T2Na2CO33H2O2
ʵ�鲽�裺ȡ3.5g Na2CO3����10mL H2O������0.1g�ȶ������ô���������������ȫ�ܽ��6.0mL 30%H2O2��15min�ڻ������뵽������ƿ�У�ʵ��װ����ͼ����Ӧ1Сʱ����1g�Ȼ��ƺ��ýᾧ��Ȼ����ˣ�����һ�ܺ��أ�
��1��װ�������������ܵ������� �� ʹ����ˮԡ�������� ��
��2����������NaCl�����ԭ���� ��
��3��2Na2CO33H2O2���ֽ⣬�䷴Ӧ����ʽ�ɱ�ʾΪ ��
��4�������������ⶨ
ȷ��ȡ����0.2000g������250mL��ƿ�У���100mLŨ��Ϊ6%��������Һ����0.0200mol/LKMnO4����Һ�ζ�����¼KMnO4����Һ���ĵ����Ϊ32.70mL���������������㹫ʽ��Q%=��40cV/m����100%[c��KMnO4����ҺŨ�ȣ�mol/L����V�����ĵ�KMnO4����Һ�����L����m������������g��]�ζ��յ���ж�����Ϊ �� ����������Ϊ ��
��5����Ʒ���ȵIJⶨ
Ϊ�˲ⶨ��Ʒ��2Na2CO33H2O2����������������˼��ַ������漰��ͬ�ķ�Ӧԭ����
����һ ��������MnO2��Ͼ��ȣ��������еμ�ˮ�������������������������м��㣮
������ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com