
| A. | 通过化学变化一定能改变物质的性质 | |
| B. | 人们所使用的材料,都是纯度越高越好 | |
| C. | 氧化还原反应中一定会发生电子转移 | |
| D. | 某元素由化合态变为游离态,该元素有可能被氧化,也有可能被还原 |
分析 A.化学变化中物质有新物质生成;
B.人们所使用的材料,在乎的是材料的性能;
C.发生电子转移的反应是氧化还原反应;
D.某元素由化合态变为游离态,该元素的化合价可能升高,也可能降低.
解答 解:A.化学变化物质的种类发生了改变,物质的性质一定改变,故A正确;
B.人们所使用的材料,在乎的是材料的性能,并不是材料的纯度,例如合金比纯金属性能优越,故B错误;
C.氧化还原反应中会发生电子转移,故C正确;
D.某元素由化合态变为游离态,该元素的化合价可能升高,也可能降低,即该元素有可能被氧化,也有可能被还原,故D正确.
故选B.
点评 本题考查物质的变化和氧化还原反应,题目难度不大,注意氧化还原反应的本质是电子转移.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有大量Ba2+的溶液中:HCO3-、Fe3+、Na+、SCN- | |
| B. | 由水电离的c(OH-)=10-14mol•L-1 的溶液中:S2-、Cl-、Na+、K+ | |
| C. | 滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2- | |
| D. | 加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(CO)=c(H2) | |
| B. | 单位时间内断裂2个H-O键的同时生成了1个H-H键 | |
| C. | 容器内反应温度不再改变 | |
| D. | 容器内的混合气体密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
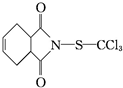 )是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )
)是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )| A. | 克菌丹的分子式为C9H8O2NSCl3,属于芳香族化合物 | |
| B. | 克菌丹易溶于水,在加热条件下不能与NaOH溶液反应 | |
| C. | 克菌丹能与溴的CCl4溶液发生取代反应使之褪色 | |
| D. | 克菌丹在一定条件下能发生取代、加聚等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中MgCl2的物质的量为0.1 mol | |
| B. | 当加入87.5 mL NaOH溶液时,沉淀质量最大 | |
| C. | 当加入90.0 mL NaOH溶液时,溶液中NaAlO2与NaCl的物质的量之比为2:35 | |
| D. | 当100 mL NaOH溶液刚好完全消耗时,Al3+恰好全部转化为Al${O}_{2}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:Na+、Fe2+、SO42-、MnO4- | |
| B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:K+、Na+、Cl-、HCO3- | |
| C. | 0.1 mol•L-1的NH4I溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 0.1 mol•L-1的CuSO4溶液中:Mg2+、Al3+、Br-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com