
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1CH3COONa溶液:H+、Al3+、Cl-、NO3-
B.含有NaNO3的溶液:H+、Fe2+、SO42- 、Cl-
C.能使甲基橙变红的溶液:K+、Na+、NO3-、Cl-
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
四种短周期元素在元素周期表中的相对位置如图所示,
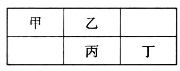
其中丙元素最外层电子数是其电子层数的2倍。下列叙述正确的是
A.四种元素的单质中,丙单质的熔、沸点最高
B.丁元素氧化物对应水化物的酸性一定强于丙
C.乙元素形成的单核阴离子还原性强于丙
D.丁元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B.反应Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)在常温下不能自发进行,则ΔH<0
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
D.CH3COOH溶液加水稀释后,溶液中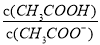 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
氮氧化物与悬浮在大气中海盐粒子的相互反应:
4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+ Cl2(g),ΔH
2NaNO3(s)+2NO(g)+ Cl2(g),ΔH
在恒温条件下,向2 L恒容密闭容器中加入0.4mol NO2和0.2 mol NaCl,10 min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为α。下列叙述中正确的是
A.10min内NO浓度变化表示的速率v(NO)=0.01 mol·L-1·min-1
B.若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于α
C.若升高温度,平衡逆向移动,则该反应的ΔH>0
D.若起始时向容器中充入NO2(g) 0.1 mol、NO(g)0.2 mol和Cl2(g)0.1 mol(固体物质足量),则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
组别 | 甲 | 乙 | 丙 |
A | Mg | FeSO4 | O2 |
B | Al2O3 | HCl | NaOH |
C | CO2 | H2O | Na2O2 |
D | NaHCO3 | Ca(OH)2 | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港市高三上学期期中化学试卷(解析版) 题型:实验题
(16分)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:

(1)指出提取碘的过程中有关的实验操作名称:① ,② 。
(2)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。

实验控制在较低温度下进行的原因是 ;锥形瓶里发生反应的离子方程式为
(3)在第②步操作过程中,可加入的有关试剂是 。
A.酒精 B.四氯化碳 C.醋酸 D.苯
(4)含碘离子的溶液也可以采用下图方法得到碘
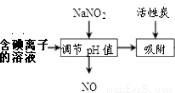
①加入NaNO2并调节pH<4,反应的离子方程式 __________________。
②流程中生成的NO尾气有毒,工业上将其与O2按一定比例通入NaOH制备NaNO2,
写出反应的化学方程式: ____________________。
(5)要测量含碘离子的溶液中I-的浓度,取25 mL该溶液,先加几滴KSCN溶液,再逐滴滴入0.1 mol·L-1FeCl3溶液, 若消耗FeCl3溶液20.4 mL,则含碘离子的溶液中I-的浓度为 。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港市高三上学期期中化学试卷(解析版) 题型:选择题
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为3Fe2++2S2O32-+O2+4OH- Fe3O4+S4O62-+2H2O。下列说法正确的是
Fe3O4+S4O62-+2H2O。下列说法正确的是
A.O2是氧化剂,S2O32-和Fe2+是还原剂
B.每生成1 mol Fe3O4,则转移电子数为2 mol
C.参加反应的氧化剂与还原剂的物质的量之比为1:2
D.若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆复旦中学高一上学期期中化学试卷(解析版) 题型:选择题
等物质的量的Fe,Mg,Al分别与足量的物质的量浓度相同的盐酸完全反应,消耗盐酸的体积比为
A.2:3:1 B.2:2:3 C.3:2:1 D.1:3:2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省衢州市五校高一上学期期中化学试卷(解析版) 题型:实验题
(16分)现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL0.25 mol/L的稀H2SO4。
可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒⑥容量瓶 ⑦托盘天平 ⑧药匙。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2)经计算,需浓H2SO4的体积为 。现有①10 mL ②50 mL ③100 mL三种规格的量筒,应选用的量筒是 (填代号)。
(3)将浓H2SO4加适量蒸馏水稀释,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度处。改用 加蒸馏水到瓶颈刻度的地方,使溶液的 。振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中:能引起误差偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com