
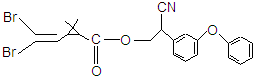
 拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述不正确的是( )
拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述不正确的是( )| A. | 属于芳香化合物 | B. | 属于卤代烃 | ||
| C. | 具有酯类化合物的性质 | D. | 在一定条件下可以发生加成反应 |
科目:高中化学 来源: 题型:多选题
| A. | FeBr2溶液中通入少量Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
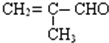 ,请推测其具有的化学性质,填写下列空白:
,请推测其具有的化学性质,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜作阳极,其电极反应式:Cu2++2e-=Cu | |
| B. | 电解过程中,电解质溶液中c(Cu2+)不变 | |
| C. | 电解后,阴极上还附有极少量的Fe和Ni | |
| D. | 电解后,可用阳极泥来提炼金、银等贵金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L 二氧化硫气体中含有0.5NA个SO2分子 | |
| B. | 常温下,3.2g硫与足量铁粉充分反应,转移的电子数为0.2 NA个 | |
| C. | 1 mol 苯分子中含有3 NA个碳碳双键 | |
| D. | 0.1mol•L-1的Na2S溶液中含有0.2NA个Na+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 与金属钠作用时,键①断 | |
| B. | 燃烧时,①②③④⑤键均断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在银催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
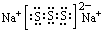 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减缓反应速率,将饱和食盐水滴加到烧瓶中的电石上来制取乙炔 | |
| B. | 实验室制乙烯时应将无水乙醇缓慢加入到浓硫酸中,并加入碎瓷片以防暴沸 | |
| C. | 将浓氨水逐滴加入到2%的硝酸银溶液中至产生的沉淀恰好溶解即制得银氨溶液 | |
| D. | 苯甲酸的重结晶实验中,粗苯甲酸全溶后再加入少量蒸馏水,目的是有利于趁热过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com