
| A、只有乙醇 |
| B、只有乙酸乙酯、乙醇 |
| C、只有乙酸 |
| D、乙醇、乙酸 |
科目:高中化学 来源: 题型:
| A、所有的电子在同一区域里运动 |
| B、同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
| C、电子云图通常用小黑点来表示电子的多少,黑点密度大,电子数目大 |
| D、能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高富氧底吹熔池炼铜新工艺反应炉如图
高富氧底吹熔池炼铜新工艺反应炉如图查看答案和解析>>
科目:高中化学 来源: 题型:
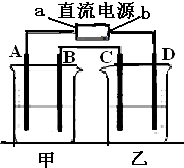 电解原理在化学工业中有广泛应用.如图中甲、乙为相互串联的两电解池.请回答:
电解原理在化学工业中有广泛应用.如图中甲、乙为相互串联的两电解池.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、脂肪 | B、乙酸 |
| C、葡萄糖 | D、蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 15 |
| 16 |
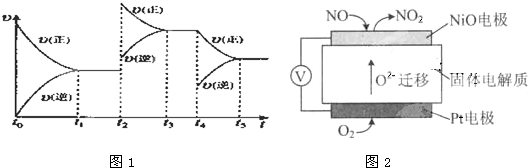
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达平衡时,SO2的消耗速率必定等于O2的生成速率的2倍 |
| B、达平衡时,升高温度,逆反应速率增加,正反应速率减小 |
| C、达平衡后,若保持压强不变,充入少量氖气,则平衡向左移 |
| D、达平衡后,若保持体积不变,充入少量O2气体,则平衡向右移,SO2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌 |
| D、硝酸常温下能与铜反应,说明硝酸有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属氧化物一定不是碱性氧化物 |
| B、HCl、H2S、NH3都是电解质 |
| C、漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器常用于物质分离 |
| D、Fe(OH)3、FeCl2、CuS都不能直接用化合反应制备 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com