
某探究小组用测量HNO3与大理石反应过程中因二氧化碳逸出质量减小的方法,研究影响反应速率的因素。限选试剂:(实验过程中不考虑稀硝酸的挥发)
1.0mol·L-1 HNO3、2.0mol·L-1 HNO3、细颗粒大理石、粗颗粒大理石、35 ℃水浴
(1)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol·L-1 |
| ① | 常温 | 粗颗粒大理石 | |
| ② | 常温 | 粗颗粒大理石 | 2.0 |
| ③ | | 粗颗粒大理石 | 2.0 |
| ④ | 常温 | | 2.0 |
(1)1.0、35 ℃水浴、细颗粒大理石(各空1分)
(2)大理石的质量(2分)
(3) ①量筒 ②B ③偏大(各空2分)
解析试题分析:(1)影响化学反应速率的因素:温度,浓度,压强,催化剂,反应物的表面积。题中给出了3个变量,要想测得每个变量对化学反应速率的影响,应先控制其他两个变量不变,观察第三个变量对化学反应速率的影响。所以①测的是浓度对化学反应速率的影响。③测的是温度对化学反应速率的影响、④测的是反应物的表面积对化学反应速率的影响。
(2)大理石的质量
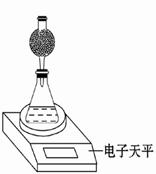
(3)①量筒 ②因为此实验采用“测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素”, 质量减小的为二氧化碳的质量。因为干燥管也在电子天平上,质量也计入称量结果,为了测得二氧化碳损失的质量,则干燥管中不可含有吸收二氧化碳的碱石灰。同时为减少二氧化碳逸出所带走的水蒸气造成的实验误差,采用无水CaCl2 、P2O5固体做干燥剂,另外干燥管中不可盛放液体,故D项浓硫酸不选。因为取消干燥管,则二氧化碳逸出所带走的水蒸气造成实验误差,使得减少的质量=m二氧化碳+m水。③使得所测速率偏大。
考点:本题考查实验探究的思维方法及仪器的使用等相关知识。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:计算题
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。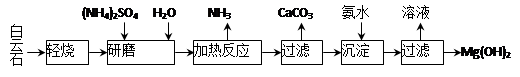
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。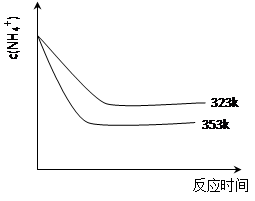
②由图可知,随着温度升高: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)Na2S2O8溶液可降解有机污染物4-CP,原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-)。通过测定4-CP降解率可判断Na2S2O8溶液产生(SO4-·)的量。某研究小组探究溶液酸碱性、Fe2+的浓度对产生(SO4-·)的影响。
(1)溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
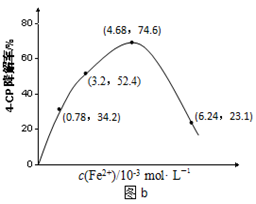
(2)Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。
已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+,此外还可能会发生:SO4-· + Fe2+=SO42- + Fe3+
① 实验开始前,检验FeSO4溶液是否被氧化的试剂是 (化学式)。如被氧化可以观察到的现象是 。
②当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为 %,4-CP降解的平均反应速率的计算表达式为 。
③当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。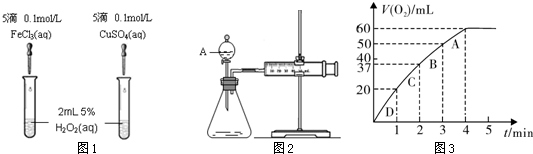
(1)定性分析:如图1可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。
②实验时放出气体的总体积是 mL。
③A、B、C、D各点反应速率快慢的顺序为: > > > 。
解释反应速率变化的原因 。
④H2O2的初始物质的量浓度是 (请保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂:1.00 mol·L-1 HNO3、2.00 mol·L-1 HNO3,细颗粒大理石、粗颗粒大理石,35 ℃水浴。
(1)他们能完成哪些因素对速率影响的探究?
____________________________________________________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
(3)整个实验中应控制的不变量是硝酸溶液体积和 。
(4)该实验小组用如图实验装置进行实验。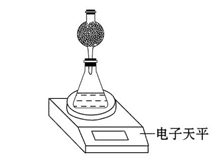
①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有 。
②干燥管中应放置的试剂是 。
| A.碱石灰 | B.无水CaCl2 |
| C.P2O5固体 | D.浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤②中加热所用仪器的名称是___________________;
(2)步骤③中洗涤沉淀的操作是___________________________________。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用下图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表: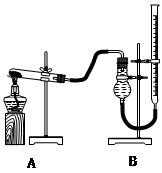
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2 g | 无其他物质 | |
| ⑤ | 1.2 g | CuO 0.5 g | |
| ⑥ | 1.2 g | MnO2 0.5 g | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
甲酸甲酯水解反应方程式为:HCOOCH3 + H2O  HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表。甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,已知相同条件下氨水的电离程度大于NH4+的水解程度,则下列有关推论不正确的是
| A.若混合后溶液pH=7,则c(NH4+)=c(Cl-) |
| B.若b=2a,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.若a=2b,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列表述中,合理的是
| A.将水加热,Kw增大,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com